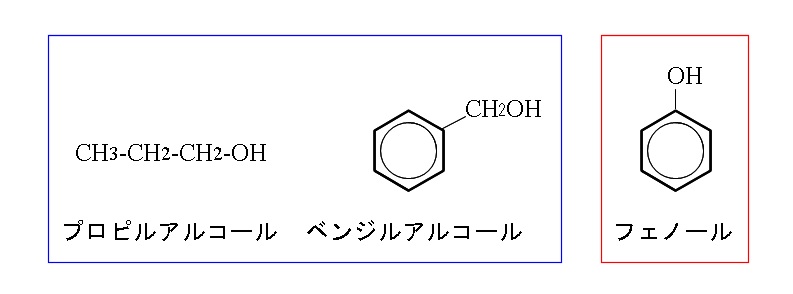
フェノールというのは固有の名前でもあるのですがベンゼン環などに結合している水素原子がヒドロキシ基で置き換えられた化合物の総称でもあります。ここでは代表的なフェノール類について一般的性質と特徴を構造式とともにまとめておきます。
フェノール類とは?
ベンゼン環やナフタレン環に結合している水素原子がOH基(ヒドロキシ基)で置換された形の化合物を総称してフェノールと言います。
固有の物質を示すフェノール(石炭酸)がありますので、区別するためにここではフェノール類としておきます。
広い意味でいう場合はフェノールとはフェノール類のことですが、高校化学ではフェノールは石炭酸と呼ばれる固有物質を指していると考えていいでしょう。
ベンゼン環などに直接結合しているOH基の数によって1価フェノール、2価フェノールなどに分類されます。
アルコールもOH基を持っていますがアルコールのOH基は鎖状炭化水素の骨格に直接結合している点がフェノール類とは違います。
一般的性質
①無色の結晶です。
常温で液体のものも例外的にはありますが、同程度の分子量の芳香族感化水素に比べると融点・沸点ともに高いです。
OH基があるので分子間で水素結合するからですね。
②1価フェノールはわずかに水に溶け、エーテルやアルコールなどの有機溶媒には良く解けます。
2価以上のフェノール類は親水基であるOH基が増えるので水への溶解度は増します。
③フェノールのOH基は水素を電離するので、水溶液は極めて弱いですが酸性を示します。
※
アルコールのOH基は中性です。
フェノールのOH基が酸性を示すのはベンゼン環にある電子の非局在性にあります。どういうことかというと、ベンゼン環では電子が環全体で共有されていて、フェノールのOH基から水素原子が取れた陰イオンの状態でも、負電荷が分散するので安定して存在できるからです。
\( \mathrm{C_6H_5OH \rightleftharpoons C_6H_5O^- + H^+ }\)
(比較的に右の方向に進みます。)
ところが、エチルアルコールのようなアルコールでは電子は個々の原子に局在化していて、
非局在電子を持たないので陰イオンとして安定して存在するとことができません。
つまり水素イオンを生じにくいということですね。
\( \mathrm{C_2H_5OH \rightleftharpoons C_2H_5O^- + H^+}\)
(右方向への変化は起こらない。)
④塩化鉄(Ⅲ)と特殊な呈色反応を示します。
フェノール(石炭酸)とは紫色の呈色反応となり、石炭酸の検出に良く用いられるので覚えておくと良いです。
フェノール類のいくつかを取り上げて特徴を説明しておきます。
フェノール(石炭酸)
分子式
\( \mathrm{C_6H_6O}\)
示性式
\( \mathrm{C_6H_5OH}\)
構造式
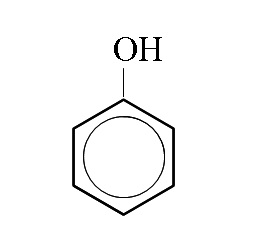
ベンゼン環にOH基が1つ入ったフェノールを石炭酸といいます。
石炭酸のことをたんにフェノールと呼ぶこともありますが、高校化学ではフェノールはこの石炭酸を示していることが多いです。
①融点40.8℃の柱状結晶で、水に少し溶けます。
②水溶液は弱酸性を示します。
酸性を示すといっても炭酸よりも酸性は弱いのでフェノールのナトリウム塩に炭酸を加えると弱酸が遊離されることからフェノールが遊離されます。
\( \mathrm{C_6H_5OH + NaOH \rightleftharpoons C_6H_5ONa + H_2O }\)
\( \mathrm{C_6H_5ONa + CO_2 + H_2O \rightleftharpoons NaHCO_3 + C_6H_5OH }\)
③塩化鉄反応は紫色です。
④毒性が極めて強いです。手に触れると皮膚を侵すので取扱注意です。
フェノール樹脂の原料や医薬品合成の原料として使われます。
製法以前はコールタールの分留をしていましたが、需要が大きくなるにつれベンゼンから合成されるようになっています。
①クロロベンゼンに水酸化ナトリウム水溶液を混ぜ、高温・高圧にして反応させます。
\( \mathrm{C_6H_5Cl + NaOH \rightarrow C_6H_5OH + NaCl }\)
②ベンゼンに濃硫酸を加えてベンゼンスルホン酸をつくり、炭酸ナトリウムを加えてナトリウム塩とした後、固体の水酸化ナトリウムでアルカリ融解し、さらに硫酸を作用させてフェノールを作ります。
\( \mathrm{C_6H_6 + H_2SO_4 \rightarrow C_6H_5SO_3H + H_2O }\)
\( \mathrm{C_6H_5SO_3Na + 2NaOH \rightarrow C_6H_5ONa + Na_2SO_3+ H_2O }\)
\( \mathrm{C_6H_5ONa + H_2SO_4 \rightarrow C_6H_5OH + NaHSO_4}\)
③クメン法は有名な製法で、現在のフェノールの製法はクメン法が用いられます。
⇒ フェノールの反応と製法(クメン法他)
クレゾール
分子式
\( \mathrm{C_7H_8O}\)
示性式
\( \mathrm{C_6H_4(OH)CH_3}\)
構造式
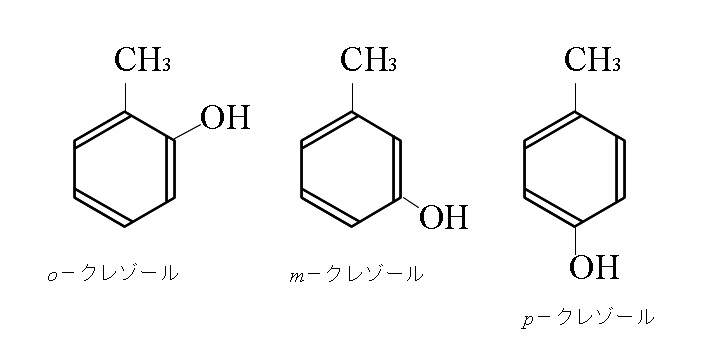
ベンゼン環にOH基とCH3(メチル基)を1個ずつ持った1価フェノールです。
2つの官能基の位置からオルト、メタ、パラの3つの異性体があり、性質はフェノール(石炭酸)に似ています。
フェノールメチルエーテル
\( \mathrm{C_6H_5-O-CH_3}\)
はクレゾールの官能基異性体です。
ナフトール
分子式
\( \mathrm{C_{10}H_8O}\)
示性式
\( \mathrm{C_{10}H_7OH}\)
構造式
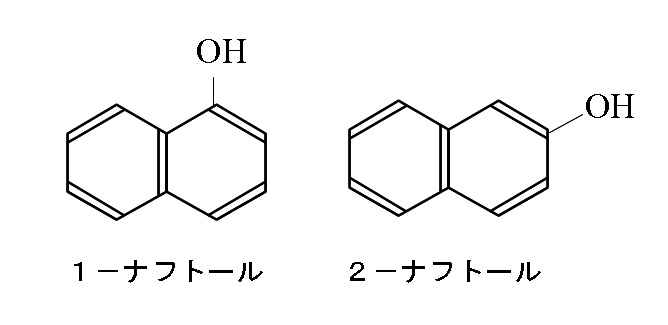
ナフトールはナフタレン環にOH基が1つついた形の化合物で、OH基の位置によって1-と2-の2種類の異性体があります。
水には溶けにくい結晶ですが、塩基性水溶液には良く溶けます。
アルコールとフェノールの違い
フェノール類とアルコールの違いについては別のページでも書いていますがもう一度まとめておきます。
両方ともOH基を持ちますが、アルコールは鎖式炭素にOH基が結合したもので、フェノール類は芳香族系環式炭素にOH基が結合したものです。
両者は似た性質もありますがかなり違った性質もあります。
鎖式炭素に結合するOH基をアルコール性水酸基、
芳香族系環式炭素に結合したOH基をフェノール性水酸基といいます。
両者の違いは以下の5つが特徴的です。
①水溶液はアルコールが中性で、フェノールは弱酸性。
②水溶液に水酸化ナトリウムを加えるとアルコールは反応しないが、フェノールはナトリウム塩をつくる。
③ハロゲンを作用させると、アルコールは反応しないが、フェノールでは環の炭素に結合している水素が直接置換される。
④塩化鉄(Ⅲ)溶液を加えると、アルコールは反応しないが、フェノールは呈色反応する。
⑤酸化剤を作用させると、アルコールは参加されてアルデヒドまたはケトンになりますが、フェノールでは環につく水素の部分が酸化されOH基を生じる。
以上です。
でも同じようなことが書いてありますが、この記事ではフェノール類を主にまとめておきました。