鎖式の不飽和炭化水素であるアルケン、アルキンの性質と慣用名などを取り上げて見ます。
アルカンに名前と構造は似ていて二重結合や三重結合が加わるだけなのですが構造と性質が違うので反応も変わります。
置換反応よりも付加反応が起こりやすくなります。
アルケンの特徴と構造
鎖式炭化水素のうち、
炭素原子間に二重結合を1つだけ持つ不飽和炭化水素を「アルケン」といいます。
分子式の一般形は、\(\mathrm {C_nH_{2n}}\) です。
アルケンの名前を炭素原子の少ない順に見ていきます。
炭素一つでは二重結合は作れませんのでメタンににたアルケンはありません。
アルケンの名前の付け方は、
アルカンの「アン(ane)」という語尾を「エン(ene)」
にすれば良いだけなので覚えやすいですが、
正式名称(IUPAC名)ではなく慣用名で呼ばれるものもありますので覚えておく必要があります。
問題には慣用名で出されることが多いからです。
左にアルカン、右にアルケンを並べて見ます。括弧書きしている名前が慣用名です。
メタン-無し
エタン - エテン(エチレン)
プロパン- プロペン(プロピレン)
ブタン - ブテン
ペンタン- ペンテン
ヘキサン- ヘキセン
と続きます。簡単でしょう?
アルケンの構造でアルカンと違うのは二重結合部分は自由回転がきかず、
「平面構造」をしているということです。
分子全体が平面なのではありませんよ。二重結合部分が平面ということです。
エチレンは全体で平面構造になっていますよね。
エチレンの製法と性質
エチレンはエタノール(\(\mathrm {CH_3CH_2OH}\))の脱水でできます。
エタノールに濃硫酸を加え約160℃~170℃で加熱するとエチレンが生成します。
\(\mathrm {CH_3CH_2OH} → 濃硫酸、170℃ → \mathrm {CH_2=CH_2}\)
(温度が120℃くらいだとジエチルエーテルが生成するので少し温度は上げておきます。)
エチレンは不飽和の二重結合を持っているので付加反応を起こしやすいです。
例えば白金触媒などを用いて水素と付加反応させると二重結合が開いて単結合のエタンになります。
\(\mathrm {CH_2=CH_2} + \mathrm {H_2} → \mathrm {CH_3-CH_3}\)
塩素 \(\mathrm {Cl_2}\) を付加させるとジクロロエタンになります。
\(\mathrm {CH_2=CH_2} + \mathrm {Cl_2} → \mathrm {CH_2Cl-CH_2Cl}\)
(1,2-ジクロロエタンです。1,1-ではありません。)
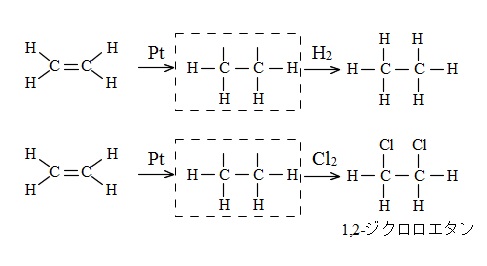
ここでは二重結合を切ると両方の炭素に手が一本ずつ残り、そこに水素や塩素が引っ付くとイメージしてくれれば良いです。
条件をそろえると二重結合をもつ分子どうしは次々に付加反応を起こし結合して行きます。このことを付加重合といいます。
エチレンも付加重合し高分子化合物であるポリエチレンを生成します。
付加重合の結果生成した高分子を重合体といいます。
(「ポリ」は「たくさんの」という意味です。)
⇒ 高分子化合物の種類と反応(重合と縮合)と特徴
アルキンの構造と特徴
アルケンと同様に、鎖式炭化水素のうち、炭素原子間に三重結合を1つだけ持つ不飽和炭化水素を「アルキン」といいます。
分子式の一般形は、\(\mathrm {C_nH_{2n-2}}\) です。
アルキンの名前の付け方は、アルカンの「アン(ane)」という語尾を「イン(yne)」にすれば良いだけです。
アルケンのようにIUPAC(アイユーパック)名ではなく慣用名で呼ばれるものもありますので覚えておきましょう。
問題には慣用名で出ます。
左にアルカン、真ん中にアルケン、右にアルケンを並べてます。
メタン-無し-無し
エタン -エテン(エチレン)-エチン(アセチレン)
プロパン-プロペン(プロピレン)-プロピン(メチルアセチレン)
ブタン -ブテン-ブチン
ペンタン-ペンテン-ペンチン
ヘキサン-ヘキセン-ヘキシン
と続きます。アルケンと同じで簡単でしょう?
「アン-エン-イン」です。
アルケンの二重結合部分は平面構造でしたが、
アセチレンの三重結合部分は直線構造になります。
だからアセチレン( \(\mathrm {H-C}\equiv \mathrm {C-H}\) )は分子全体で一直線になっています。
アセチレンの製法と性質
アセチレンはカーバイド(炭化カルシウム)に水を反応させると生成します。
\(\mathrm {CaC_2} + \mathrm {H_2O} → \mathrm {\color{red}{C_2H_2}} + \mathrm {Ca(OH)_2}\)
アセチレンは純粋なものであれば無色で無臭の気体ですが、
硫化水素などの不純物が特有の臭いを出しているので臭いがあるように感じます。
水にはわずかに溶け、有機溶媒には良く解けます。
燃やすとすすをたくさん出して燃えます。燃焼熱は大きいです。
\(\displaystyle \mathrm {C_2H_2} + \frac{5}{2} \mathrm{O_2}=\mathrm {2CO_2+H_2O}+\mathrm{1301kJ}\)
アセチレンもエチレン同様付加反応は起こりやすいです。
水素や塩素などのハロゲンや水や酢酸なども付加しますが、
エチレンと違うのは付加が一段階で終わらず二重結合を残さず進んでしまうことが多いということです。
反応例を示しておきます。
アセチレンと塩素の反応
三重結合へのハロゲンの付加は実は二重結合に付加するより起こりにくいです。
そのためアセチレンにハロゲンを付加させる反応をさせると、
三重結合に付加したら次の二重結合への付加も続いて起こります。
\(\mathrm{CH\equiv CH} + \mathrm {\color{red}{Cl_2}} → \mathrm {CH\color{red}{Cl}=CH\color{red}{Cl}}\)
(1,2-ジクロロエチレンの生成)
続いて、
\(\mathrm {CHCl=CHCl} + \mathrm {Cl_2} → \mathrm {CHCl_2CHCl_2}\)
(1,1,2,2-テトラクロロエタンの生成)
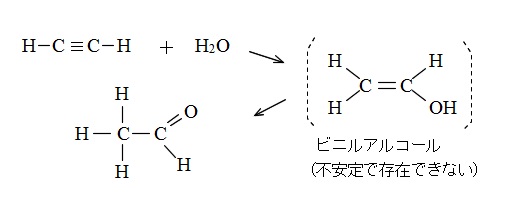
アセチレンと水の反応
アセチレンは水とも反応します。
中間体としてビニルアルコールを生成しますが不安定で存在できず、
すぐさまアセトアルデヒドにかわります。
\(\mathrm{CH\equiv CH} + \mathrm {H_2O} → (ビニルアルコール) → \mathrm {CH_3CHO}\)
ただ、アセチレンは付加反応は起こりやすいですが高分子をつくるような付加重合は起こりにくいです。
3分子重合してベンゼンをつくる、程度で覚えておきましょう。
もちろん付加した後は二重結合になっている分子もありますので重合できないわけではありません。
塩酸と付加反応させた塩化ビニルなどは重合するとポリ塩化ビニルという高分子になりますからね。
このように不飽和の炭素結合は付加反応が良く起こります。
アルカンは置換反応、アルケン、アルキンはともに付加反応が主になりますので覚えておきましょう。
アルカンについては名前も覚えなくてはなりませんので
⇒ 飽和炭化水素 アルカンとシクロアルカン
を参考に復習しておきましょう。
次はアルコールです。
ここから誘導体が次々に出てきますので有機化学の始まりといっても良いです。