化学反応が起こるには活性化エネルギーが必要になります。
粒子どうしが反応できる状態(活性化状態)になるために必要な活性化エネルギーの求め方と、反応の速さと反応熱および触媒による変化も見ておきましょう。
反応熱と活性化エネルギーにはどのような関係があるか確認しておきましょう。
活性化状態
化学反応が起こるには反応物となる粒子が接触(衝突する)必要があります。
※
ただ、接触すれば反応するかといえばそうではありません。衝突回数と反応する粒子の割合は0が10個以上並ぶくらい低いと考えられます。
例えば水素とヨウ素の反応
\(\mathrm{H_2+I_2\rightarrow 2HI}\)
では水素とヨウ素が反応しやすい角度で衝突し、そのとき十分なエネルギーをもった状態でなければ反応しません。
このように反応が起こるほどのエネルギーの高い状態を「活性化状態」といいます。
このとき水素とヨウ素は原子状態になっているわけではありません。
H-HとI-Iのままだけど衝突すればH-Iになるだけのエネルギーを持った状態です。
このような状態を活性錯体というのです。
※
もし水素とヨウ素が原子状態にならなければ反応が起こらないとすれば、結合エネルギーを見てみると温度を1000度以上にする必要がありますが、実際には400度付近で反応が起こります。これは結合を切ってしまわなくても反応が起こる活性化状態が存在することを意味します。
活性化エネルギーと求め方
活性化状態になるまでに反応物の粒子が必要とするエネルギーを「活性化エネルギー」といいます。
衝突する粒子の運動エネルギーの和が活性化エネルギーより大きい場合は反応が起こります。
運動エネルギーの和が活性化エネルギーより小さい場合は反応は起こりません。
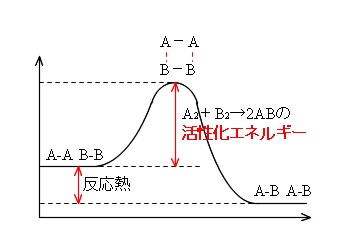
この活性化エネルギーは反応の種類によって違っています。
活性化エネルギーの小さな反応は速度が大きいです。
逆に活性化エネルギーの大きな反応の反応速度は小さいです。
活性化エネルギーの求め方は、
反応のエネルギー状態を示したグラフにおいて、
「活性化状態のエネルギーと反応物のエネルギーとの差」
になります。
グラフには数値が与えられますので読み取ってください。
「反応物のエネルギーと生成物のエネルギーの差」
は「反応熱」なのでしっかり覚えておきましょう。
一般にイオン反応は活性化エネルギーは小さいので反応は進みやすいです。
また、温度を10℃(10K)上昇させると反応速度は数倍大きくなります。
しかしこれは粒子の衝突回数が急激に増えるわけではありません。
衝突回数はそれほど増えないけど、衝突したときに反応するだけの運動エネルギーを持った粒子が増えるということです。
もう一度言います。
温度を上昇させると衝突回数が増えるというよりも、活性化エネルギーよりも大きな運動エネルギーを持った粒子が増えるということですよ。
※
ボルツマン分布を用いて説明すれば少しは分かり易くなりますが省略します。w
触媒と活性化エネルギー
触媒とは、別のところでも書いていますが、
「反応の前後で自身は変化せず、反応速度を大きくする物質」
をいいます。
例えば過酸化水素は常温ではゆっくり分解しますが、
少量の酸化マンガン(\(\mathrm{MnO_2}\))や鉄イオン(\(\mathrm{Fe^{3+}}\))が加わると激しく分解します。
このとき、\(\mathrm{MnO_2}\) や \(\mathrm{Fe^{3+}}\) は反応前後で変化しません。
この酸化マンガンや鉄イオンを触媒といいます。
※
反応速度を大きくする触媒を正触媒といい、小さくする触媒を負触媒といいます。
通常は触媒といえば正触媒でしたよね。
触媒が反応速度を大きくするのは、触媒と反応物が結びついて活性化エネルギーの小さい反応経路をとるからです。
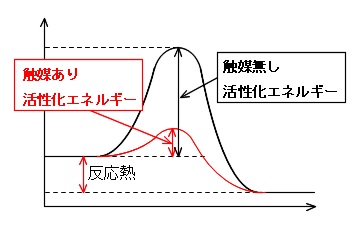
ヘスの法則によれば
「反応熱の大きさは反応前後の物質の状態のみで決まる」
ので、触媒を加えると反応速度は大きくなりますが、反応熱は変わりませんね。
また、グラフの頂点が活性化状態ということですよ。
触媒の種類
触媒には正触媒と負触媒がありますが、もう一つ反応時の状態によって、
「均一触媒」と、「不均一触媒」があります。
均一触媒はイオンや酵素などの反応物と均一に混合した状態ではたらく触媒で、
不均一触媒は金属など固体の触媒が多く、反応物とは均一に混合せず触媒の表面で活性化状態をつくり出す触媒です。
金属触媒の表面に反応物が吸着すると反応物の結合が弱められ活性化状態になりやすいからです。
触媒のはたらきは中間体などは考えなくて良いので、
活性化エネルギーを小さくする反応経路を作り、
反応速度を大きくする、と覚えておきましょう。
触媒を加えても反応熱は変わらないことも要注意です。
反応速度を変える条件はいくつもあります。
どのようなものがあったか確認しておいてください。
次は化学平衡です。
ややこしい定数計算がありますが、気楽に見てみましょう。