炭素数が多くなると分子式は同じでも炭素骨格の異なる異性体が存在します。ここでは構造式の異なる構造異性体や構造式は同じでも立体構造の異なる立体異性体(幾何異性体と光学異性体)について基本的な分類をしておきましょう。異性体は構造式を書かないと分かりません。
異性体とは
有機化合物のうち、分子式は同じでも構造や性質の違う物質を異性体といいます。
大きく分けると、構造式の異なる構造異性体と、構造式が同じでも立体的な構造が異なる立体異性体とに分けられます。
さらに立体異性体には幾何異性体と光学異性体とに分けられます。
1つひとつ例をあげながら見ていきましょう。
構造異性体
例えば、飽和炭化水素である分子式 \(\mathrm {C_5H_{12}}\) はペンタンと呼ばれますが構造の違いで名前が変わってきます。
\(\mathrm {CH_3CH_2CH_2CH_2CH_3}\) n-ペンタン
(「n-」は「ノーマル」です。)
\(\mathrm {CH_3CH_2CH(CH_3)CH_3}\) 2-メチルブタン
(2番目の炭素にメチル基が1つついたブタンと見ます。)
\(\mathrm {CH_3C(CH_3)_2CH_3}\) 2,2-ジメチルプロパン
(2番目の炭素にメチル基が2つついたプロパンとみます。)
※名前の付け方は別のところで説明します。

そして構造式が違うと性質も変わります。それが構造異性体です。
立体異性体
構造式が同じでも分子どうしの立体的な構造が違う異性体を立体異性体といい、
幾何異性体と光学異性体があります。
幾何異性体
二重結合を持つ炭素どうし間では自由回転ができず平面構造をしています。
その二重結合をつくる炭素原子に異なる原子や官能基が結合すると結合する位置によって2種類の異性体ができます。
‘同じ側’を意味する「シス型」と、
‘反対側’を意味する「トランス型」の2種類です。
アセチレン \(\mathrm {HC\equiv CH}\) に塩素 \(\mathrm {Cl_2}\) を付加させると1,2-ジクロロエチレンが生成します。
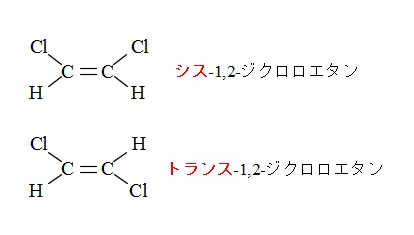
構造式は \( \mathrm {CHCl=CHCl}\) と同じですが、立体的な構造は違っています。
光学異性体
炭素には手が4本あります。
共有結合が4本できるということですが、4種類とも異なる原子や官能基と結合している炭素を「不斉炭素」といいます。
不斉炭素を持つ化合物には鏡に映した像のように重ねることのできない異性体が1対存在します。
これを光学異性体といいます。
例えば乳酸 \(\mathrm {CH_3C^*H(OH)COOH}\) は不斉炭素を持ち光学異性体が存在します。
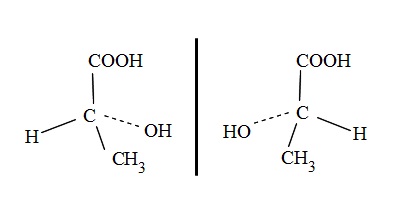
この光学異性体は化学的性質や沸点や融点といった物理的性質も同じですが、光学的性質だけが異なります。
※
光学的性質というのは分からなくて良いのですが、平面状に振動する光を右に回転させたり左に回転させる性質のことです。
立体異性体は種類も少ないですが、構造異性体は炭素数が増えるとかなり多くなりますので、異性体を書き出すときは構造式を書いて考えるクセをつけておいてくださいね。
それでも抜け落ちてたりしますのであれやこれやと試して見て可能性を探してください。
構造式はそれぞれの説明で入れていますが
を基本にして下さい。