窒素とリンは15族の非金属元素です。単体と化合物の製法と性質を見ておきます。窒素は空気の8割近くを占める気体で酸性雨にも関係しているので注目しておきましょう。硝酸の製法オストワルト法についても触れておきます。リンは同素体の存在ですね。
窒素単体
(\(\mathrm{N_2}\))
製法は、工業的には酸素と同じく液体空気の分留です。
実験室での小規模であれば、濃いめの亜硝酸アンモニウム水溶液を加熱すると得られます。
\( \mathrm{NH_4NO_2\rightarrow 2H_2O+N_2\uparrow}\)
加熱した銅に空気を通すと酸素が除かれ多少不純物を含んだ窒素が得られます。
不純物はアルゴンなどの希ガスです。
※
「アルゴン」の名前はギリシャ語の「怠け者」から来ているそうです。笑
それくらい反応性が乏しいということですね。気体の窒素は希ガスに次いで反応性が乏しいです。
窒素の化合物
窒素は常温では反応性が悪いですが高温にすると酸素と化合し「窒素酸化物」となります。
酸性雨の原因となる一酸化窒素(\(\mathrm{NO}\))や二酸化窒素(\(\mathrm{NO_2}\))などのノックス(\(\mathrm{NO}_x\))と呼ばれるものは窒素酸化物です。
一酸化窒素の製法と性質
(\(\mathrm{NO}\))
一酸化窒素は銅と希硝酸を反応させると生成します。
\( \mathrm{3Cu+8HNO_3\rightarrow 3Cu(NO_3)_2+4H_2O+2NO}\)
無色で無臭の気体で、水には溶けにくいので水上置換で捕集します。
空気中で簡単に酸化されて二酸化窒素になります。
二酸化窒素の製法と性質
(\(\mathrm{NO_2}\))
二酸化窒素は銅と濃硝酸を反応させると生成します。
\( \mathrm{Cu+4HNO_3\rightarrow Cu(NO_3)_2+2H_2O+2NO_2}\)
赤褐色で特異臭のする気体で、水に溶けやすく、空気より重いので下方置換で捕集します。
水に溶けると硝酸になります。強酸ですね。
硝酸の製法と性質
(\(\mathrm{HNO_3}\))
硝酸の工業的な製法「オストワルト法」を紹介します。
簡単に言えば「アンモニアを酸化して硝酸を生成する」方法です。
第1段階
アンモニアを白金触媒を用いて酸化して一酸化窒素を生成します。
\( \mathrm{4NH_3+5O_2\rightarrow 4NO+6H_2O}\)
アンモニアと空気を混ぜて800℃くらいでちょっと白金触媒の網に触れさせる程度です。
ちなみに白金は宝石の装飾に使われる高価なプラチナ(\(\mathrm{Pt}\))のことですよ。w
第2段階
一酸化窒素を空気中の酸素で酸化して二酸化窒素とします。
\( \mathrm{2NO+O_2\rightarrow 2NO_2}\)
第3段階
二酸化窒素を水に吸収させて硝酸をつくります。
\( \mathrm{3NO_2+H_2O \rightarrow 2HNO_3+NO}\)
これがオストワルト法です。
硝酸は「無色」で「揮発性」がある「強酸」です。
「酸化力が強く」イオン化傾向の小さな銅や銀も溶かします。
ただし、アルミニウム、鉄、ニッケルは不動態になるので濃硝酸には溶けません。
⇒ 金属の酸化還元 イオン化傾向と反応性
※
硝酸は光や熱で分解されやすいので、褐色ビンに入れて冷暗所で保存します。
アンモニアも窒素の化合物です。
アンモニアの工業的製法は窒素と水素を触媒を用いて直接合成する「ハーバーボッシュ法」ですね。
⇒ アンモニアの製法ハーバーボッシュ法(温度変化と平衡移動の利用)
触媒は四酸化三鉄(\(\mathrm{Fe_3O_4}\))です。
実験室レベルなら塩化アンモニウム(弱塩基の塩)に水酸化カルシウム(強塩基)を加えて加熱すると発生します。
\( \mathrm{2NH_4Cl+Ca(OH)_2\rightarrow CaCl_2+2H_2O+2NH_3}\)
アンモニアは無色ですが、刺激臭のある気体です。
空気よりも軽く、水に非常に溶けやすく弱い塩基性を示します。
\( \mathrm{NH_3+H_2O \rightleftharpoons NH_4^++OH^-}\)
塩基性ということは、赤色リトマス紙は青色に変色しますね。
アンモニアの確認(検出)方法は、塩化水素と反応して塩化アンモニウムの白煙を生成することです。
塩化アンモニウム(\(\mathrm{NH_4Cl}\))は固体です。
リンの同素体と化合物
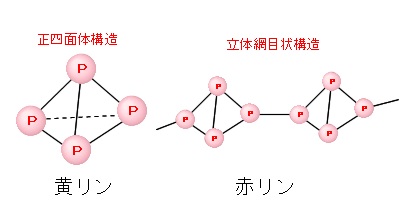
リン(\(\mathrm{P}\))には同素体が存在します。黄リンと赤リンです。
特徴を簡単に分けておきますので覚えて下さい。
黄リン:淡黄色の固体、空気中で自然発火する、水中保存、猛毒。
赤リン:赤褐色の粉末、空気中で自然発火しない、空気中保存できる、わずかに毒性あり。
要は赤リンの方が安全です。笑
黄リンはネズミを駆除する薬(殺鼠剤)、農薬に使われます。
赤リンはマッチをこするときのあのガサガサ面に使われます。
実は自然界にはリンの単体は存在しません。
リン酸塩の形で地中に存在します。
リン酸塩を高温にするとリンの蒸気が発生しますのでこれを水中で凝縮させることでリンの単体(黄リン)が得られます。
\( \mathrm{2Ca_3(PO_4)_2+6SiO_2+10C\rightarrow 6CaSiO_3+10CO+P_4}\)
この \(\mathrm{P_4}\) は4個のリン原子が手を三本ずつ出し合って正四面体構造をつくっています。
黄リンを空気と遮断して長時間加熱すると赤リンになります。赤リンは黄リンの結合一本が切れて別の黄リンとつながった立体の網目構造をしています。
リンの化合物
空気中でリンを燃焼させると十酸化四リン(\(\mathrm{P_4O_{10}}\))が生成します。
これは白色の粉末で吸湿性が大きく、強力な乾燥剤となります。
さらに十酸化四リンに水を加えて加熱するとリン酸が生じます。
\( \mathrm{P_4O_{10}+6H_2O\rightarrow 4H_3PO_4}\)
リン酸は空気中の水蒸気を吸収する潮解性を持ち、水に溶けて酸性を示します。
同素体について
基本的なところからおさえておいた方が良いですよ。
同位体、同素体の根本的な意味はセンターでも良く問われますからね。