中和反応は酸と塩基の性質の打ち消し合いなので、滴定を行うと少しずつpHに変化が生じます。その変化を曲線にしたものが滴定曲線です。中和点付近で起こるpHジャンプと酸や塩基の種類によって指示薬は何を使えばよいかを見てみましょう。
滴定曲線
中和滴定を行うと溶液のpHが変化しますが、その変化を、酸や塩基の滴下量とpHを軸とした曲線を滴定曲線といいます。
滴定に用いる酸や塩基によって、
①強酸と強塩基
②弱酸と強塩基
③強酸と弱塩基
④弱酸と錯塩基
による中和滴定に分けられ、曲線の種類(形)も4種類に分類されます。
この曲線の形を選ぶ問題も多いので見分け方を覚えておきましょう。
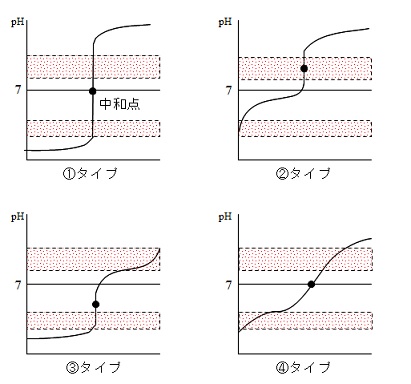
中和曲線を見ると中和点付近で急にpHが変化する範囲がありますが、
これをpHジャンプといいます。
このpHジャンプの中点に中和点がありますが、普通はpHジャンプを中和点と見なしてかまいません。
弱酸と弱塩基のよる中和滴定を行わないのは中和点(pHジャンプ)の見分けがつきにくいからです。
①強酸と強塩基で滴定する場合
中和点でpHはちょうど7になり、pHジャンプの範囲はかなり広くなります。
指示薬は酸性側に変色域をもつメチルオレンジと塩基性側に変色域をもつフェノールフタレインのどちらでもかまいません。
②弱酸と強塩基で滴定する場合
中和点は塩基性側にかたよって、pHジャンプの範囲は強酸強塩基の場合よりせまくなります。
指示薬は塩基性側に変色域をもつフェノールフタレインを使います。
③強酸と弱塩基で滴定する場合
中和点は酸性側にかたよります。弱酸と強塩基と同様にpHジャンプの幅は強酸強塩基の場合より狭くなります。
指示薬は酸性側に変色域をもつメチルオレンジを使います。
④弱酸と弱塩基で滴定する場合
pHジャンプがほとんど見られませんので、中和点を見つけることができないので中和滴定には向きません。
滴定曲線がどうなるかは確認しておくと良いですが、中和滴定に弱酸弱塩基の組み合わせはしないというのも覚えておきましょう。
つまり、中和滴定には、強酸か強塩基を用いて行うということです。
滴定曲線の見方
曲線を見る前に中和点についての注意があります。
中和点というのは水素イオンと水酸化物イオンの物質量が等しくなった点であり、
強酸と強塩基の場合は中性、
強酸と弱塩基だと酸性より、
弱酸と強塩基だと塩基性よりになります。
必ず中性になるとは限りませんので注意しておいてください。
①強酸と強塩基の滴定曲線
強酸を強塩基で滴定する場合、
最初はpHは1とか2とか、かなり低い数値(酸性)から始まるはずです。
強塩基を加えるにしたがって急にpHが高くなり、
かなりpHの高い数値(塩基性)まで上昇するはずです。
中和点を過ぎると強塩基のみの性質を表すようになるからです。
強塩基を強酸で滴定する場合はこの逆になります。
②弱酸と強塩基の滴定曲線
弱酸を強塩基で滴定する場合、
最初は割とpHは低いところから始まりますが、
強塩基を加えることですぐにpH上昇に変化が現れ、
pHの高いところで落ち着くはずです。
これも強塩基の性質のみを表すようになるからです。
弱塩基を強酸で滴定する場合は逆の曲線を描きます。
③強酸と弱塩基の滴定曲線
強酸を弱塩基で滴定する場合、
最初は強酸の性質を表しているのでpHはかなり酸性よりにあり、
弱塩基を加えても反応は現れ難いですがpHジャンプ幅は割と小さく、
酸性側にかたよるはずです。
中和点を過ぎても弱塩基性しか示さないのでpHも中性は超えますが、
強塩基とはいえない10程度まで上がれば良い方でしょう。
弱塩基を強酸で滴定する場合はこの逆の曲線です。
④弱酸と弱塩基の滴定曲線
弱酸を弱塩基を滴定する場合、
pHジャンプがないようなだら~とした変化なるのですぐに分かります。
逆の滴定の場合も同様です。
滴定曲線の見分けかた
滴定曲線が何を何で滴定したかは、
・滴定を始めたときのpH
・中和点のpH
・滴定終了時のpH
を見れば①~④のどのタイプの滴定かが分かります。
滴定曲線と始まりの位置と終わりの位置をもう一度見てください。
よくわかると思います。
で指示薬の変色域も見落とさないようにしましょうね。