疎水コロイドと親水コロイドの違いと凝析と塩析という現象について説明しておきます。さらに保護コロイドの構造についても簡単に触れておきますので用語の意味を覚えておきましょう。計算問題は出てこないところです。
疎水コロイド
粒子自身が水を引きつける力が弱く水との親和性が小さいため、
親和せずに取り巻いている水分子が少なく、
電気的な反発が大きくなるので沈澱せずに分散している状態の
少量の電解質を加えると沈澱するコロイドを疎水コロイドといいます。
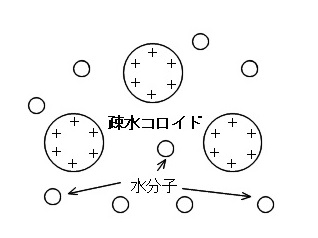
代表的な疎水コロイドに、水酸化鉄の水溶液、金属、硫黄などがあります。
凝析
疎水コロイドは水に親和していないので反対符号のイオンなどが吸着しやすい状態になっています。
そこで少量の電解質を加えると互いに集合し沈澱を起こします。
この現象を凝析といいます。
凝析はコロイドと反対符号のイオンで価数の大きなものほど凝析力は強くなります。
正コロイドには負の符号をもつ塩化物イオンや硫酸イオンが吸着しますが、
一価の塩化物イオンより二価の硫酸イオンの方が凝析力が強いということです。
\( \mathrm{Cl^-} < \mathrm{SO_4^{2-}} < \mathrm{PO_4^{3-}}\)
※
ただし、電気的な中和によるものではないので単純に2倍、3倍の凝析力とはなりませんので注意してください。
(難しく考えなくて良いところですので説明は省略します。笑)
逆に負のコロイドには正の電荷をもつイオンが吸着します。
粘土も疎水コロイドで海水中の電解質と凝析を起こし河口付近に三角州を形成します。
大きな河川の橋を通るとき、三角州があれば、「凝析の結果」だと思い出してください。w
親水コロイドと塩析
多数の水分子と親和している(周囲を水が取り巻いている)コロイドを親水コロイドといいます。
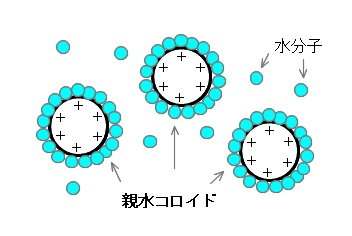
デンプンやゼラチンの溶液は親水コロイドです。
これは周りの水分子が取り除かれないと電解質がコロイドの核となる部分に近づけないためで、
少量の電解質を加えても沈澱は生じなくて、
多量の電解質を加えるとコロイドの周りの水分子が取り除かれ凝析と同じように沈澱を生じます。
この現象を塩析といいます。
例えば、豆乳に塩化マグネシウム(\(\mathrm{MgCl_2}\))などの塩を含む「にがり」を加えて豆腐ができるのも塩析です。
塩析の効果は水和力の強いイオンを含む塩ほど強くなります。
同じ価数の場合はイオン半径が小さい方が親和力は強いです。
保護コロイド
疎水コロイドに適当な親水コロイドを加えると、「親水コロイドが疎水コロイドの粒子を取り囲む」ようになります。
このとき凝析が起こりにくくなります。
この現象を「保護作用」といい、このようなはたらきをするものを保護コロイドといいます。

全体を言うのではなくて、疎水コロイドを凝析しにくくするために加えられた親水コロイドのことであることに注意してください。
まとめ
水との親和力の小さいコロイドが疎水コロイドで、
少量の電解質で凝析します。
水との親和力が大きいコロイドが親水コロイドで、
多量の電解質で塩析します。
疎水コロイドが凝析しにくくする為に加えられた親水コロイドが保護コロイドです。
コロイド粒子や溶液について
⇒ コロイド溶液のチンダル現象、透析、ブラウン運動、電気泳動
この項目は計算問題が出ない代わりに用語を覚えているか、用語の意味を理解しているかで差が出るところですよ。