反応熱にもいろいろな種類がありますので、生成熱、燃焼熱、溶解熱、中和熱の反応例と注意点を書いておきます。
発熱反応なのか吸熱反応なのかは反応物と生成物によるので反応の名前は何で決まるのかを先ずは覚えましょう。
反応熱とは
物質が化学変化をする、つまり、化学反応するときには熱の出入りが必ずあります。このときに出入りする熱量を反応熱といいます。
反応して熱を発する反応を発熱反応といい、
反応する物質(反応物)が持つ化学エネルギーが、
生成する物質(生成物)の持つ化学エネルギーよりも大きいときは発熱反応となります。
反応物の余ったエネルギーが放出されると考えて良いです。
木が燃えると周りは熱くなります。
これは木が持つエネルギーを放出するからですね。
逆に、
反応して熱を吸収する反応を吸熱反応といいます。
反応物よりも生成物の持つエネルギーの方が大きいときは吸熱反応となります。
生成物に必要な足りないエネルギーを外から吸収すると考えておきましょう。
夏の暑い日、水をまくと少し気温を下げてくれます。
「打ち水」というものですが、これは水が液体から気体になるとき熱を吸収するので周りが少し涼しくなる吸熱反応を日常に利用した例です。
反応熱をエネルギー図で説明しておきます。
各物質のもつエネルギーの大きさを表した図をエネルギー図というのですが、
上に行くほど物質の持つエネルギーは大きくなります。
反応物から生成物への反応が下を向くとき発熱反応、
上に向かって反応が起こる場合は吸熱反応となります。
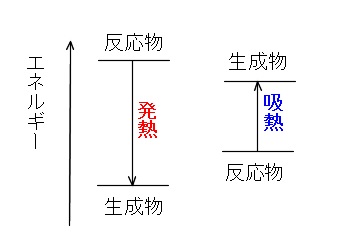
余ったエネルギーを放出するか、足りないエネルギーを吸収するかの違いです。
いろいろな反応熱
反応熱の種類を生成熱、燃焼熱、溶解熱、中和熱に分けて説明します。
熱量の単位はエネルギーと同じ「J」(ジュール)を用いますが、
反応熱の定義から表すのに適当な数値となる「\(\mathrm{kJ/mol}\)」を使います。
反応熱は熱化学方程式という方程式で表されます。
方程式の作り方は別途説明しますが左辺に反応物、右辺に生成物と反応熱書いて「\(\mathrm{=}\)」で結びます。
生成熱
成分元素単体から「化合物1mol」が生成するときの反応熱を生成熱といいます。
「反応物が単体」であることと、「生成物が1mol」のときの熱量であることが注意点です。
例えば水(液体)の生成熱は、
\( \mathrm{2H_2+O_2=2H_2O+Q}\)
の \(\mathrm Q\) ではなく、
\(\displaystyle \mathrm{H_2 \,+\, \frac{1}{2} O_2\,=\,H_2O}(液)\mathrm{\,+\,Q’}\)
の \(\mathrm {Q’}\) であるということです。
生成物である水の係数が「1」となるときの値が生成熱ですね。
生成熱には発熱反応と吸熱反応の両方があります。
燃焼熱
ある「物質1mol」が完全燃焼するときに発生する熱量を燃焼熱といいます。
この反応はすべて発熱反応となります。
\( \displaystyle \mathrm{H_2 + \frac{1}{2} O_2=H_2O+Q’}\)
は水素1molが燃焼するときの反応熱なので水素の燃焼熱でもありますね。
\( \mathrm{CH_4+2O_2=CO_2+2H_2O+Q}\)
はメタンの燃焼熱です。
二酸化炭素の係数も1なので二酸化炭素の生成熱にも見えますが、
反応物が単体ではないので生成熱ではありません。
溶解熱
ある「物質1mol」が多量の溶媒に溶ける(溶解する)ときの反応熱を溶解熱といいます。
これには発熱反応と吸熱反応の両方があります。
※
固体が液体になるとき、つまり融解するときの熱量を「融解熱」といいますが、
これは化学反応ではなく状態変化の熱量になりますので反応熱ではありません。
紛らわしいですが間違えないでください。
「蒸発熱」も状態変化の熱量になりますがまた機会があれば説明しますね。
中和熱
中和して(酸と塩基との反応)、「水が1mol」生じるときに発生する熱量を中和熱といいます。
中和はすべて発熱反応となります。
このようにそれぞれの反応に対する熱量を反応熱といいますが、
「何が1mol生成」するのか、「何が1mol反応」する反応熱なのかを見極めることが大切です。
係数が「1」なので探しやすいですが、反応名は覚えておきましょう。
次はこの反応熱を方程式で表す「熱化学方程式」の作り方を見てみましょう。
反応熱は問題に与えられることがほとんどなので覚える必要はありません。
結合エネルギーから計算する問題はありますがそれも数学の方程式よりも簡単ですから心配はいりません。
上に書いてある反応熱の名前と生成物を「1mol」で表すことが大切になるだけです。