気体が発生する反応はいろいろありますが、ここでは主な気体発生反応と捕集方法をまとめておきます。触媒なども示しておきますので性質と共に覚えておくと良いです。ここだけでも覚えておけば、気体発生の問題がかなり楽になると思いますよ。
気体別発生方法と性質と捕集方法
水素
(\(\mathrm{H_2}\))
無色・無臭:還元性あり
\( \mathrm{Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow}\)
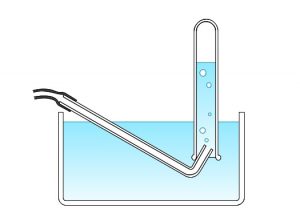
鉄(\(\mathrm{Fe}\))や亜鉛(\(\mathrm{Zn}\))などの金属に希塩酸や希硫酸を反応させると水素が発生します。
水素は水に溶けないし非常に軽い気体なので捕集方法は「水上置換」ですね。
塩素
(\(\mathrm{Cl_2}\))
黄緑色・刺激臭・水溶液酸性・酸化作用あり
\( \mathrm{4HCl+MnO_2\rightarrow MnCl_2+2H_2O+Cl_2\uparrow}\)
濃塩酸に酸化剤を加えて加熱すると塩素が発生します。
塩素は水に少し溶け、空気より重いので「下方置換」です。
酸素
(\(\mathrm{O_2}\))
無色・無臭・酸化作用あり
\( \mathrm{H_2O_2\rightarrow 2H_2O+O_2\uparrow}\)
過酸化水素水に触媒(\(\mathrm{MnO_2}\))を加えると酸素が発生します。
\( \mathrm{2KClO_2\rightarrow 2KCl+3O_2}\)
塩素酸カリウムに触媒(\(\mathrm{MnO_2}\))を加えて加熱しても酸素が発生します。
いずれにしても酸素は水に溶けにくいので「水上置換」です。
オゾン
(\(\mathrm{O_3}\))
淡黄色・特異臭・酸化作用あり
\( \mathrm{3O_2\rightarrow 2O_3}\)
酸素中で「無声放電」するとオゾンが発生します。
窒素
(\(\mathrm{N_2}\))
無色・無臭
\( \mathrm{NH_4NO_2\rightarrow 2H_2O+N_2\uparrow}\)
亜硝酸アンモニウムを熱分解すると生成します。
窒素は水に溶けないので「水上置換」です。
塩化水素
(\(\mathrm{HCl}\))
無色・刺激臭・水溶液酸性
\( \mathrm{NaCl+H_2SO_4\rightarrow NaHSO_4+HCl\uparrow}\)
塩化ナトリウムと濃硫酸の混合物を加熱すると発生します。
塩化水素は水に溶けやすく、空気より重いので「下方置換」です。
フッ化水素
(\(\mathrm{HF}\))
無色・刺激臭・水溶液酸性
\( \mathrm{CaF_2+H_2SO_4\rightarrow CaSO_4+2HF\uparrow}\)
ホタル石に濃硫酸を加えて加熱するとフッ化水素が生成します。
フッ化水素は水に溶けやすく、分子量(20)だけをみるとは空気(28.8)より軽く思えますが、
実態は2量体 \(\mathrm{(HF)_2}\) を形成し見かけは空気より重くなるので「下方置換」で捕集します。
硫化水素
(\(\mathrm{H_2S}\))
無色・腐卵臭・還元性あり
\( \mathrm{FeS+H_2SO_4\rightarrow FeSO_4+H_2S\uparrow}\)
硫化鉄(Ⅱ)を希硫酸か希塩酸と反応させると生成します。
水に少し溶けて、空気より重いので「下方置換」です。
二酸化硫黄
(\(\mathrm{SO_2}\))
無色・刺激臭・還元作用あり
\( \mathrm{Cu+2H_2SO_4\rightarrow CuSO_4+2H_2O+SO_2\uparrow}\)
銅に濃硫酸を加えて加熱すると発生します。
水に少し溶けて、空気より重いので「下方置換」です。
アンモニア
(\(\mathrm{NH_3}\))
無色・刺激臭・水溶液塩基性
\( \mathrm{NH_4Cl+Ca(OH)_2\rightarrow CaCl_2+2H_2O+2NH_3\uparrow}\)
塩化アンモニウムと水酸化カルシウムを混合して加熱すると生成します。
水に溶けやすく、空気より軽いので「上方置換」です。
一酸化窒素
(\(\mathrm{NO}\))
無色・無臭・還元作用あり
\( \mathrm{3Cu+8HNO_3\rightarrow 3Cu(NO_3)_2+4H_2O+2NO\uparrow}\)
銅と「希硝酸」を反応させると生成します。
一酸化窒素は水に溶けないので「水上置換」です。
二酸化窒素
(\(\mathrm{NO_2}\))
赤褐色・刺激臭・水溶液酸性
\( \mathrm{Cu+4HNO_3\rightarrow Cu(NO_3)_2+2H_2O+2NO_2\uparrow}\)
銅と「濃硝酸」を反応させると生成します。
二酸化窒素は水に少し溶け、空気より重いので「下方置換」です。
一酸化炭素
(\(\mathrm{CO}\))
無色・無臭・還元作用あり
\( \mathrm{HCOOH\rightarrow CO\uparrow+H_2O}\)
ギ酸を濃硫酸と共に加熱すると生成します。
一酸化炭素は水に溶けないので「水上置換」です。
二酸化炭素
(\(\mathrm{CO_2}\))
無色・無臭・水溶液酸性
\( \mathrm{CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\uparrow}\)
炭酸カルシウムと希塩酸を反応させると発生します。
水に少し溶け、空気より重いので「下方置換」です。
後で気がついたら追加するかもしれませんがこれくらい覚えておけばだいたい通用するのではないでしょうか。
それぞれの詳しい反応についてはあちこちの記事で示してありますので、各族の元素項目を検索してみて下さい。
例えば、一酸化炭素、二酸化炭素については無機物としての炭素の化合物で
などを参考にして下さい。
どこが入試に出るかは言い切れませんが、定期テストでもこの気体発生反応を外すというのは考えにくいです。