周期表14族のケイ素の性質です。炭素と同じ族だから同素体をたくさん持っているのか?そもそも単体が存在するのか?また化合物はどのような性質を持っているのか見ておきましょう。実はケイ素の酸化物は身の回りにたくさんありますよ。
ケイ素
実は、ケイ素(\(\mathrm{Si}\))の単体は天然には存在していません。
二酸化ケイ素として地中の石、岩石として存在しているので、この酸化物を還元して単体を取り出します。
具体的にはケイ砂(\(\mathrm{SiO_2}\))にコークス(\(\mathrm{C}\))を加え電気炉で2000℃以上に熱してつくります。
これは工業的な製法です。
\( \mathrm{SiO_2+2C\rightarrow Si+2CO}\)
実験室レベルでつくるなら、酸化ケイ素とマグネシウム粉末とで加熱すればケイ素単体が得られます。
マグネシウムが酸化ケイ素から酸素を奪う還元剤となるのです。
\( \mathrm{SiO_2+2Mg\rightarrow Si+2MgO}\)
ケイ素の単体は黒色の金属のような光沢のある共有結合結晶をしていて、炭素と同じというより、ダイヤモンドと同じ立体網目構造となっていて硬いですがダイヤモンドよりはもろいです。
ケイ素は電導性に特徴があって、金属と非金属の中間の電導性を持っています。
この性質をもつ物質を半導体といいます。半導体はICやLSIとしてコンピューター関係に広く利用されています。
※
ケイ素と同様な半導体はゲルマニウムもありますがここでは長くなるので詳しくは書きません。w
ケイ素の化合物
単体よりはこちらの化合物、特に酸化物には注目しておいて下さい。
試験に良く出ますから。笑
岩石中の二酸化ケイ素はかなりの量です。
地殻中の構成元素で酸素の量は一番ですが、ケイ素は2番目です。
ということは、二酸化ケイ素はかなりの割合ですよね。w
二酸化ケイ素
(\(\mathrm{SiO_2}\))
天然では石英、水晶、ケイ砂などに含まれ「石」と称されるものは二酸化ケイ素が主成分と思って良いくらいです。
共有結合結晶で、ケイ素原子と酸素原子との共有結合の繰り返しでできています。
ケイ素と酸素の結合エネルギーは大きいので硬くて融点も高いです。
光通信に使われている光ファイバーはこの二酸化ケイ素の純度を高めたものを繊維状にしてつくられています。
※
二酸化ケイ素は水や普通の酸にも溶けませんが、フッ化水素酸には溶けます。
\( \mathrm{SiO_2+6HF\rightarrow H_2SiF_6+2H_2O}\)
(\(\mathrm{H_2SiF_6}\):ヘキサフルオロケイ酸)
※※
フッ化水素(\(\mathrm{HF}\))の水溶液は「フッ化水素酸」と呼ばれるので覚えておきましょう。
二酸化ケイ素からシリカゲルまでの反応経路
二酸化ケイ素を強塩基の水酸化ナトリウムとともに加熱すると二酸化ケイ素の立体構造がこわれ二次元構造でガラス状の「ケイ酸ナトリウム」になります。
\( \mathrm{SiO_2+2NaOH\rightarrow Na_2SiO_3+H_2O}\)
さらにケイ酸ナトリウムに水を加えて加熱したものを「水ガラス」といいます。
水ガラスは無色透明で粘性のある液体です。
イオン結晶であるにもかかわらず水には溶けにくいです。
理由は構造にありますがあまり深く考えなくても良いです。
ガラスっていうくらいだから水に溶けにくい、程度でいいですよ。
この水ガラスに塩酸を加えると白色でゲル状の「ケイ酸」が沈澱します。
\( \mathrm{Na_2SiO_3+2HCl\rightarrow H_2SiO_3+2NaCl}\)
そして、ケイ酸を加熱して脱水したものが「シリカゲル」です。
シリカゲルは多孔質で水だけでなく気体も吸着するので乾燥剤や吸着剤に使われます。市販のシリカゲルはコバルト塩が混ぜてあるので吸湿したときは青色からピンク色に変色します。
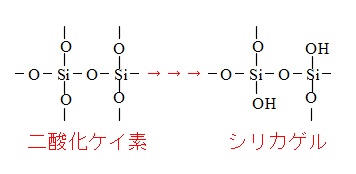
構造式を簡単に入れて見ましたが、シリカゲルの表面にある \(\mathrm{-OH}\) 基が吸着するんですよね。
もう一度ケイ素の化合物の流れを見ておくと、
「ケイ酸ナトリウム」を水と混ぜて「水ガラス」になり、
「水ガラス」に酸を加えて「ケイ酸」となり、
「ケイ酸」を加熱脱水して「シリカゲル」になる、ということです。
14族元素の炭素と合わせて
確認しておきましょう。
半導体はPC関連以外に太陽電池にも使われるなど注目度は高いですし、炭素と共にこれからも生活には欠かせないものが増えてくるでしょう。