物質を構成する結合にはイオン結合や共有結合がありますが配位結合とはどんな結合なのか?分かりにくいと思いませんか?金属に配位子が結合した錯イオンはどういう構造をしているのか、また配位子にはどのようなものがあるのかお伝えします。
配位結合
共有結合は不対電子を互いに出し合って結合します。
そうではなく、一方の原子だけが非共有電子対を出し、それを2つの原子で共有する結合が配位結合です。
例えば、
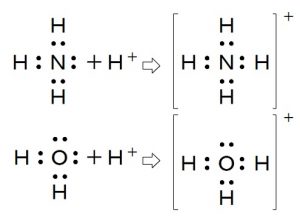
アンモニアに水素イオンが配位したアンモニウムイオン( \( \mathrm {NH_4^+}\) )ですが、水素イオンはもともと共有する電子を持っていません。
この水素イオンはアンモニアの非共有電子対を提供してもらいアンモニウムイオンを形成しているのです。
このとき、水素が4つありますがどれが後でくっついた水素かは判断出来ません。
配位した後は共有結合していた水素と差がなくなり区別できなくなるということですね。
水分子に水素イオンが配位したオキソニウムイオン( \( \mathrm {H_3O^+}\) )も水素シオンが配位結合したものです。
錯イオン
アンモニア( \(\mathrm {NH_3}\) )やシアン化物イオン( \( \mathrm {CN^-}\) )のように非共有電子対をもつ分子やイオンが金属イオンに配位結合した多原子イオンを錯イオンといいます。
このとき金属イオンに配位結合した分子やイオンを配位子といい、配位結合した数を配位数といいます。
※
配位数はギリシャ語の数詞を用いて表します。
化学ではいずれ覚えた方が良い数詞なのでここで書いておきます。
1.モノ 2.ジ 3.トリ 4.テトラ 5.ペンタ
6.ヘキサ 7.ヘプタ 8.オクタ 9.ノナ 10.デカ
(20まで覚えておけばほぼ通用しますがここでは10までとしておきます。)
配位子の呼び名は配位子とは少し変わりますので記しておきます。
| 配位子 | 化学式 | 配位子名 |
| アンモニア | \(\mathrm {NH_3}\) | アンミン |
| シアン化物イオン | \(\mathrm {CN^-}\) | シアニド |
| 水 | \( \mathrm {H_2O}\) | アクア |
| 塩化物イオン | \(\mathrm {Cl^-}\) | クロロ |
| 水酸化物イオン | \(\mathrm {OH^-}\) | ヒドロキシド |
錯イオンは金属イオンや配位数によって決まった形をとります。
例えば、
銀イオンにアンモニアが2つ配位した、
ジアンミン銀(Ⅰ)イオン( \(\mathrm {[Ag(NH_3)_2]^+}\) )は直線
銅イオンにアンモニアが4つ配位した
テトラアンミン銅(Ⅱ)イオン( \(\mathrm {[Cu(NH_3)_4]^{2+}}\) )は平面で正方形
亜鉛イオンにアンモニアが4つ配位した
テトラアンミン亜鉛(Ⅱ)イオン( \(\mathrm {[Zn(NH_3)_4]^{2+}}\) )は正四面体
鉄イオンにシアン化物イオンが4つ配位した
ヘキサシアニド鉄(Ⅱ)酸イオン( \(\mathrm {[Fe(CN)_6]^{4-}}\) )は正八面体
になります。
錯イオンの表し方と名称は、
配位数、配位子名、金属元素名、金属の酸化数を順に並べ、
陽イオンの場合は最後に「イオン」
陰イオンの場合は最後に「酸イオン」
をつけて呼びます。
錯イオンについては参考程度でいいと思いますが、配位結合については覚えておいてくださいね。
共有結合や結晶の種類は覚えておきましょう。