共有結合している分子の原子間では電子のかたよりから生じる極性が結合を強くしています。これは電気陰性度の大きさ(強さ)の違いによる静電気的なつながりが加わるためと考えられます。では電気陰性度、極性とはどのようなものなのでしょう。
電気陰性度
共有結合した原子間では電子を引きつける力が働きます。
それぞれの原子が共有電子対を引きつける強さを数値で表したものが電気陰性度です。
電気陰性度は典型元素で見比べれば十分ですが、希ガスを除いて周期表の右上に行くほど大きく(強く)なります。
※
電気陰性度の大きさを表す数値はボーリングの計算式で表すのが一般的ですが、希ガスは定義されていません。
だから周期表で一番右上にあるフッ素が電気陰性度が一番大きいと覚えておくと少しは分かり易くなります。
計算式はややこしいのでおいといて、w
電気陰性度の大きさを相対的に数値化したものを表にあげておきます。
数値が大きいほど電気陰性度が大きいということです。
| \(\mathrm H\) 2.1 | ||||||
| \(\mathrm {Li}\) 1.0 | \(\mathrm {Be}\) 1.5 | \(\mathrm {B}\) 2.0 | \(\mathrm {C}\) 2.5 | \(\mathrm {N}\) 3.0 | \(\mathrm {O}\) 3.5 | \(\mathrm {F}\) \(\color{red}{4.0}\) |
| \(\mathrm {Na}\) 0.9 | \(\mathrm {Mg}\) 1.2 | \(\mathrm {Al}\) 1.5 | \(\mathrm {Si}\) 1.8 | \(\mathrm {P}\) 2.1 | \(\mathrm {S}\) 2.5 | \(\mathrm {Cl}\) 3.0 |
| \(\mathrm {K}\) 0.8 | \(\mathrm {Ca}\) 1.0 |
見ての通り右上のフッ素が一番大きいです。
フッ素を基準に見ると電気陰性度は左に行けば小さくなり、
下に行けば行くほど小さくなると言えますね。
※
ボーリングの計算式による電気陰性度の値は、水素を2.1としたときの相対的な値です。
極性
種類の違う原子間の共有結合では共有電子対は電気陰性度の大きい原子に偏ります。
このような2原子間にある電荷の偏りを結合の極性といいます。
電荷の偏りとは例えば、
塩化水素分子( \(\mathrm {HCl}\) )では全体では中性ですが、
共有電子対は塩素原子の方へ偏り、
塩素原子はわずかですが負の電荷( \(\color{red}{\delta^-}\) )を帯び、
水素原子はわずかに正の電荷( \(\color{blue}{\delta^+}\) )を帯びます。
この相対的な電荷の偏りが極性の原因となります。
電気陰性度の差が大きいほど結合の極性も大きくなり、
同じ原子間では電気陰性度は同じなので結合の極性はありません。

2原子間の結合の極性は直線的ですぐに電気陰性度の差で見れば分かりますが、
3個以上の原子からなる分子では全体の極性は分子の形によって変わってきます。
結合の極性を打ち消すような対照的な構造をしている直線構造や正四面体構造では極性をもちません。
極性をもたない分子を無極性分子といいます。
折れ線構造や三角錐構造では極性を打ち消し合うことがないので分子全体は極性をもちます。
極性をもつ分子を極性分子といます。
※
電気陰性度の差が大きくなると共有結合ではなくイオン結合となります。
目安としては、電気陰性度の差が2.0を超える結合はイオン結合だと判断してかまいません。
極性分子と無極性分子の例
極性分子
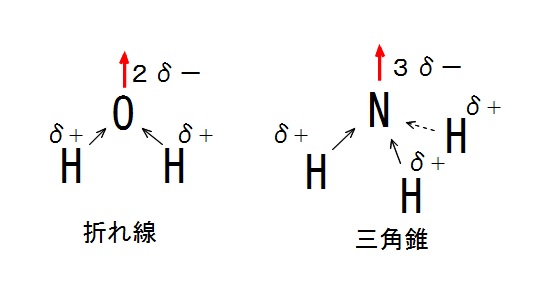
水( \(\mathrm {H_2O}\) )は折れ線型で酸素原子に電子が偏るので極性分子です。
アンモニア( \(\mathrm {NH_3}\) )は三角錐型で窒素原子に電子が偏るので極性分子です。
無極性分子
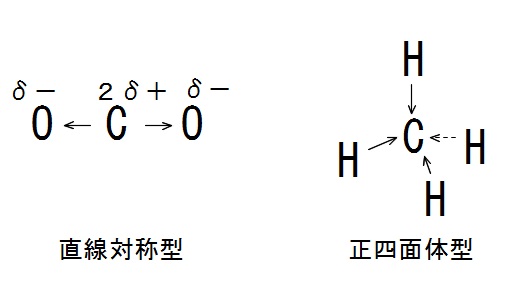
二酸化炭素( \(\mathrm {CO_2}\) )は直線構造で反対側から打ち消し合うので無極性分子です。
メタン( \(\mathrm {CH_4}\) )は正四面体構造で炭素原子に向かって均等に偏るので全体で無極性分子となります。
このように部分的に電荷の偏りがあっても分子全体では無極性となるのは分子構造によるということですね。
極性分子か無極性分子かの判断はほんの少しの電子の偏りと、分子構造によるものなのでむずかしいですよね。
簡単にまとめると
2原子間の場合は原子が違えば極性はあります。
3原子以上の分子では分子構造の対称性によるので分子の形が分からないと極性のありなしは分からない。
ということです。
分子の形は
で確認しておきましょう。