鉄やアルミニウムという身の回りにある金属は混じり合っているものが多く単独でなり立っているものは少ないです。ここでは純物質としての金属は原子どうしどういう結合しているのか結晶構造と、自由電子とは普通の電子と違うのか、性質とともに基本的なことを学びましょう。
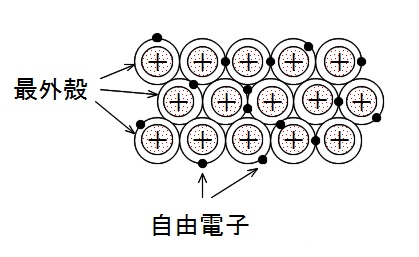
自由電子
一般に金属は電子を放出し陽イオンになりやすい性質があり、
金属原子が集まるとこの陽イオンになった状態で、
最外殻が重なった多数の金属原子が1つになった構造となります。
金属原子の1つひとつから放出された価電子は、
最外殻の重なりを通じて自由に原子間を動き回ることができるのですが、
このような電子を自由電子といいます。
金属の性質にはいくつか特徴がありますがこれらの性質は自由電子によるものが多いです。
金属結合
自由電子は特定の原子間で共有されるのではありません。
すべての金属原子で共有されて金属どうしを結びつけているのです。
このような自由電子を仲立ちとした金属原子の結合を金属結合といいます。
つまり自由電子は金属中の原子を「自由に動き回っている電子」ということですね。
金属結晶
金属の単体では、金属原子が上下左右前後に規則正しく並んでいて、繰り返し同じ結合である金属結晶をつくっています。
この繰り返しの結合でできている結晶構造の最小の繰り返し単位構造を単位格子といいます。
金属の結晶構造は3つあります。
ナトリウムやカリウムの体心立方格子。
アルミニウムや銅の面心立法格子。
マグネシウムや亜鉛の六方最密構造。
面心立法格子と六方最密構造は重なり方は違いますが、同じ大きさの球をもっとも密になるように重ねた構造をしていて最密構造ともいいます。
結晶構造のもっとも基本的な単位を単位格子といいますが、六方最密構造の六角柱は単位格子を表していません。
詳しくは「化学」でやりますのでこの六方最密構造と単位格子の図は教科書で確認してください。
金属の性質
前にも書きましたが、金属の性質は自由電子の存在が大きく影響しています。
金属の表面が光沢を持つのは、自由電子が存在しているから金属の表面で光の反射が起こりやすいためです。この光沢を金属光沢といいます。
自由電子は電気や熱エネルギーを運ぶため電気や熱の伝導性が大きいです。
鉄をたたくと伸びて広がるように、
金属をたたくと薄く広がる性質を持っていてこれを展性といい、引っ張ると伸びる性質を延性といいます。
※
金属結合は共有結合ほどは強くありません。
ですが、1原子あたりの自由電子の数が多いほど金属結合は強くなり、硬さが増し融点も高くなります。
自由電子の数が1原子あたり同じであれば金属原子が小さいほど金属結合は強くなります。
アルカリ金属などは自由電子が少ないので金属の中では柔らかくて融点の低いものが多いです。
ナトリウムやカリウムはナイフで切れるくらい柔らかいですが、鉄や銅は切れませんよね。
因みに良く聞く金属でいうとカリウムの融点は63℃ですが、鉄の融点は1535℃というくらい違ってきます。
金属については基礎ではなく本格的に学ぶには化学にはいってからで良いです。
今は基本的な性質を覚えておくと良いでしょう。
これで一応化学結合が出そろいました。
結合の種類、見分けられるようになりましたか?