陽イオンと陰イオンの強い静電気力でできた結合をイオン結合といます。
原子は他の原子と化学結合をしていろいろな物質を構成します。
その結合の1つがイオン結合です。クーロン力でできるイオン結合とはいったいどのような仕組みでできているのか、イオン結合でできた結晶、イオン結晶にはどのような性質があるのか見てみましょう。
イオン結合
陽イオンと陰イオンは電気的に引き合います。
この2つのイオンの間に働く静電気的な引力をクーロン力というのですが、
このクーロン力で結びついた結合をイオン結合といいます。
一般的に陽性の強い(陽イオンになりやすい)金属元素と、
陰性の強い(陰イオンになりやすい)非金属元素はイオン結合しやすいです。
イオン結合している物質には、
塩化ナトリウム( \(\mathrm {NaCl}\) )
水酸化カルシウム( \(\mathrm {Ca(OH)_2}\) )
硫酸マグネシウム( \(\mathrm {MgSO_4}\) )
などのように、
陽イオンとなる金属イオンと、
陰イオンとなる塩化物イオンや硫酸イオンや水酸化物イオンなどとの化合物があります。
イオン結合の仕組み
イオン結合では陽性の元素が電子を提供し、陰性の元素の最外殻に電子を供給することで両方の元素が安定な電子配置をとることで成立しています。
その際陽性元素は+イオンになり、陰性元素は-イオンとなるため静電気的な引力(クーロン力)によって引き合うようになるのです。
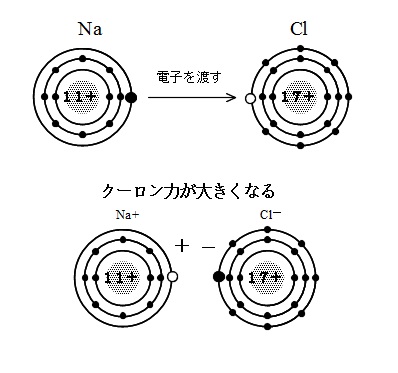
例えば塩化ナトリウム( \(\mathrm {NaCl}\) )の場合、
ナトリウム( \(\mathrm {Na}\) )が電子を1つ放出し、
ナトリウムイオン(\(\mathrm {Na^+}\) )になります。
\(\hspace{4pt}\mathrm {Na}\,\rightarrow \,\mathrm {Na^+}+e^-\)
塩素( \(\mathrm {Cl}\) )がその放出された電子を受け取り、
塩化物イオン( \(\mathrm {Cl^-}\) )になります。
\(\hspace{4pt}\mathrm {Cl}\,+e^{-}\,\rightarrow \,\mathrm{Cl^{-}}\)
この \(\mathrm {Na^+}\) と \(\mathrm {Cl^-}\) がクーロン力で結合する。
それがイオン結合です。
因みに異符号の電荷では引き合う力(引力)ですが、
同符号の電荷が反発する力は斥力(せきりょく)といいます。
クーロンが発見したからクーロン力というんです。
イオン結晶
固体の塩化ナトリウムのように陽イオンと陰イオンが規則正しくイオン結合して配列した結晶をイオン結晶といいます。
陽イオンと陰イオンは交互に規則正しく配列しています。
ただし、ナトリウムと塩素は1:1で対になって分子状態になっているのではなくて、いくつもの原子どうしで交互に並び安定性を増していますが詳しくは後で結晶構造のところでやりましょう。
(後の「イオン結晶の仕組み」で少しだけ説明しておきます。)
イオン結合物質(イオン結晶)の性質
イオン結合は結合としては強いのでその結晶は融点は高く、硬いです。
硬いですが強い力を加えると、元素の配列がくずれ斥力が働くようになり割と簡単に割れてしまいます。
結晶自体は固体で電気を通しませんが、
液体の状態や溶液になるとイオンの自由度が増して電気を通すようになります。
水に溶けやすいのもイオン結晶の特徴の1つです。
※
イオン結合している物質の中でも、
\(\,\mathrm{AgCl\,,\,BaSO_4\,,\,CaCO_3}\,\)
などのように水にとけにくいものもありますので注意しておきましょう。
イオン結晶の仕組み
金属結合でできる結晶格子については改めて説明するとして、
\(\,\mathrm{Na^+}\,\)と\(\,\mathrm{Cl^-}\,\)で結晶ができる場合を考えて少し説明しておきます。
(あまり深く考えなくても良いですよ。)
クーロン力には方向性がありません。
なので\(\,\mathrm{Na^+}\,\)と\(\,\mathrm{Cl^-}\,\)が\(\,1\,\)個ずつ結合したからといって、
イオン結合は飽和されるわけではありません。
\(\,\mathrm{Na^+}\,\)の周囲にはできる限り多くの\(\,\mathrm{Cl^-}\,\)が立体的に配置され、
\(\,\mathrm{Cl^-}\,\)の周囲にはできる限り多くの\(\,\mathrm{Na^+}\,\)が立体的に配置されることによって、
連続的に配置された立方体の結晶が作られます。
これは\(\,\mathrm{Na^+}\,\)がただ1つの\(\,\mathrm{Cl^-}\,\)と結合するよりも、
より多くの\(\,\mathrm{Cl^-}\,\)と結合を増やした方が全体的により安定するからです。
そのため、イオン結合している物質は分子ではなくて、
たくさんの原子の対が集まってできているので、
その組成比をもっとも簡単にとった組成式で表されます。
詳しくは「組成式」で説明します。
イオンとクーロン力と電子配置については
⇒ イオンの成り立ちと生成 電離と陽イオン陰イオン
でしっかり復習しておきましょう。