水素結合した分子は同じくらいの分子量の分子より沸点や融点が高い場合があります。これは水素結合と呼ばれる静電気的な結合が原因です。水素結合の仕組みと何故結合が強くなるのかその強さを沸点の比較をしながら見てみましょう。
水素結合とは
水素原子( \(\mathrm H\) )と電気陰性度の大きい元素とからできている分子、
特にフッ素や酸素や窒素の水素を含む化合物である、
フッ化水素( \(\mathrm {HF}\) )、
水( \(\mathrm {H_2O}\) )、
アンモニア( \(\mathrm {NH_3}\) )などでは、
極性分子よりもさらに強い静電気的な引力がはたらきます。
水素原子を介したこのような結合を水素結合といいます。
水素結合も分子間力の1つですよ。
水素原子の電子がフッ素のような電気陰性度の大きい原子へ電気的に引っ張られて、水素原子が丸裸の原子核に近い状態になるためにできる結合です。
分子間力と違うのは、分子間力は互いにはたらく力ですが、
この水素結合は電気陰性度の大きい原子に水素原子の電子が引っ張られるという方向性があることですね。
フッ化水素 \(\mathrm{H-F}\) の例でいうと、
フッ素の電気陰性度が大きいので、
1つのフッ化水素分子内でフッ素が水素の電子を引きつけ、
水素が強めの正の電荷を帯びるため、
違う分子のフッ素とその正の電荷を帯びた水素と引き合うということです。
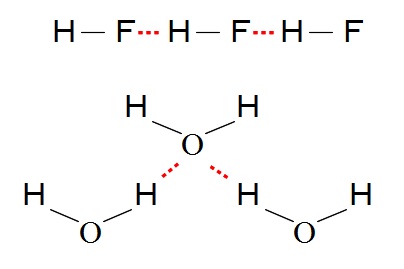
水素結合は1つの分子内の話ではなく、
2つ以上の分子での相互的な結合だということを理解しておけば水素結合は分かり易くなります。
上の図の中で赤で示したように、
水素結合は点々(・・・)で表します。
(点の数は決まっていませんよ。)
簡単に言うと、
直接はつながっていないのですが、
電気的に結びつくことで巨大分子のような状態になるので、
沸点や融点は同じくらいの分子量の物質よりも高くなるということですね。
※
一般的に構成元素が同じ場合、分子量が大きいほど沸点融点は高くなります。
※
生物を学んでいる人はDNAの二重らせん構造を知っていると思います。
DNAは2本のヌクレオチド鎖が対になってらせん構造をしているのですが、
あの二重らせん構造は塩基どうしが水素結合している物なのです。
塩基どうしが水素結合して対になりますが、
立体的に直線では安定しないので少しずつ回転して、
塩基対10個くらいで1回転するような結合をしています。
水素化合物の沸点
分子量が同じくらいの水素化合物の沸点を比較すると、
炭素やケイ素などの14族の水素化合物は無極性分子で沸点は低いです。
逆に、15族(窒素など)や16族(酸素など)や17族(フッ素など)の水素化合物は極性分子で沸点は高いです。
特に窒素、酸素、フッ素の水素化合物である、
アンモニア( \(\mathrm {NH_3}\) )、
水( \(\mathrm {H_2O}\) )、
フッ化水素酸( \(\mathrm {HF}\) )は、
同族の水素化合物よりも極端に沸点が高くなっています。
これらの分子は、分子間にはたらく力であるファンデルワールス力よりも水素結合がより強くはたらいているからです。
一般的には分子量が大きい物質ほど沸点は高くなるのですが、
水素結合が強くはたらく物質では分子量が小さくても沸点が高くなるという、
規則性にあてはまらないケースが出てくるということですので気をつけておきましょう。
ファンデルワールス力、水素結合、極性引力などすべて分子間力です。
などを参考にして確認して下さい。
水素結合の強さは、化学結合である共有結合、イオン結合、金属結合よりは弱いですよ。
でも、ファンデルワールス力よりは強いです。
だから水素結合してできた物質は、
同じくらいの分子量の物質より沸点や融点は異常に大きくなるのです。
化学を学んで基礎に戻ってきた人向けの話ですが、
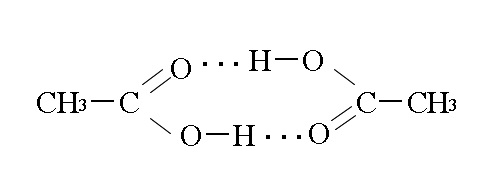
酢酸は水素結合によって二量体となるので分子量の割に沸点が高いですよね。
約2倍の分子量と同等の沸点を示します。
「酢酸はなぜ同分子の異性体より沸点が高いか?」
という質問があったら、
「水素結合によって二量体を生成しているから。」を答えにしておけば良いでしょう。
細かくいうなら、
カルボキシ基( \(\mathrm{COOH-}\) )の水素と他の分子のカルボキシ基の二重結合酸素が水素結合しているから、
でしょうね。
水素結合だけをいうわけではありませんが、
「会合(かいごう)」も複数分子の集まりによるものです。
いずれ学ぶことになるでしょう。
結合の強さには種類があります。
水素結合と同じように弱い結合もありますので確認しておきましょう。
共有結合などの強い結合もあります。
化学結合の違いは結晶の性質にも現れます。