2020年(令和2年)度センター試験化学の第4問と第5問の問題と解説です。
第4問は脂肪族、芳香族有機化合物の性質とエステルの合成、第5問は高分子化合物とアミノ酸の性質です。
選択問題が少ないので第6問、第7問もまとめて解説しておきます。
2020年センター試験化学の問題(4,5,6)
問題です。
第\(\,4\,\)問 ⇒ 2020年センター試験化学第4問の問題
第\(\,5\,\)問 ⇒ 2020年センター試験化学第5問の問題
第\(\,6,7\,\)問 ⇒ 2020年センター試験化学第6,7問(選択問題)
第4問炭化水素の性質とエステルの合成
〔問1〕脂肪族炭化水素の性質
誤りを含むものを選びます。
①メタン\(\,\mathrm{CH_4}\,\)は正四面体構造をしていて炭素水素間の距離(結合の長さ)はすべて等しいです。
②エタン\(\,\mathrm{C_2H_6}\,\)の炭素2つは単結合\(\,\mathrm{(\,-C-C-\,)}\,\)、
エテン(エチレン)\(\,\mathrm{C_2H_2}\,\)炭素2つは2重結合\(\,\mathrm{(\,-C=C-\,)}\,\)です。
二つ目の結合は一つ目ほど強い共有結合ではありませんが、単結合の場合より結合距離は短くなります。
エタンの方が結合距離が長いというのは正しいです。
③プロパン\(\,\mathrm{C_3H_8}\,\)は飽和炭化水素で結合はすべて単結合です。
炭素同士の単結合は直線ではなく折れ線状\((\,112^{\circ}\,)\)になっています。
④アルカンの一般式は\(\,\mathrm{C_nH_{\color{red}{2n+1}}}\,\)ですが、
\(\,\mathrm{\color{red}{CH_3}-CH_2-CH_2-\cdots -CH_2-\color{red}{CH_3}}\,\)
環を構成する炭素同士の結合部分の水素2つが少なくなるので、
\(\,\mathrm{\color{blue}{-CH_2}-CH_2-CH_2-\cdots -CH_2-\color{blue}{CH_2-}}\,\)
シクロアルカンの一般的な分子式は\(\,\mathrm{C_nH_{\color{blue}{2n}}}\,\)です。
\(\,\fbox{ 1 }\,\)の答え \(\,\underline{ ④ }\,\)
〔問2〕有機物の燃焼
分子式\(\,\mathrm{C_9H_nO_2}\,\)の化合物が燃焼しても(酸化しても)、
水素原子のモル数は変わらないことから求めます。
\(\begin{eqnarray}
\mathrm{C_9H_\color{red}{n}O_2}&=&12\times 9+1\times n+16\times 2\\
&=&108+n+32\\
&=&140+n
\end{eqnarray}\)
なので\(\,\mathrm{C_9H_nO_2}\,\)\(\,\mathrm{30\,mg}\,\)中の水素原子のモル数は
\(\begin{eqnarray}\displaystyle
\frac{30\times 10^{-3}}{140+n}\times \color{red}{n}\,(\,\mathrm{mol}\,)
\end{eqnarray}\)
また、\(\,\mathrm{18\,mg}\,\)の水\(\,\mathrm{H_\color{blue}{2}O=18}\,\)中には
\(\begin{eqnarray}\displaystyle
\frac{18\times 10^{-3}}{18}\times \color{blue}{2}\,(\,\mathrm{mol}\,)
\end{eqnarray}\)
あるので、
\(\begin{eqnarray}\displaystyle
\frac{30\times 10^{-3}}{140+n}\times \color{red}{n}&=&\frac{18\times 10^{-3}}{18}\times \color{blue}{2}\\
\frac{30\,n}{140+n}&=&2\\
30\,n&=&2(140+n)\\
28\,n&=&280\\
n&=&10
\end{eqnarray}\)
\(\,\fbox{ 2 }\,\)の答え \(\,\underline{ ② }\,\)
〔問3〕芳香族の酸性度
脂肪族のアルコールの\(\,\mathrm{-O\color{blue}{H}}\,\)はほぼ中性と考えて良いです。
しかし、
フェノール\(\,\mathrm{C_6H_5-O\color{red}{H}}\,\)
ベンゼン環の影響で弱い酸性を示すようになります。
(フェノール性ヒドロキシ基)
安息香酸\(\,\mathrm{C_6H_5-COOH}\,\)
カルボキシル基\(\,\mathrm{-COO\color{red}{H}}\,\)は普通に酸性があります。
ベンシルアルコール\(\,\mathrm{C_6H_5-CH_2-OH}\,\)
ベンゼン環と\(\,\mathrm{-OH}\,\)の間に\(\,\mathrm{-CH_2-}\,\)が入るので、
ベンゼン環の影響を受けにくく脂肪族の\(\,\mathrm{-O\color{blue}{H}}\,\)と同様に中性と考えて良いです。
よって酸性度か大きい順に
\(\mathrm{C_6H_5-COOH\,>\,C_6H_5-OH\,>\,C_6H_5-CH_2OH}\)
\(\,\fbox{ 3 }\,\)の答え \(\,\underline{ ⑤ }\,\)
〔問4〕鏡像異性体(光学異性体)
鏡像異性体、光学異性体とは1つの炭素に4つの異なる原子や原子団がひっついているものです。
この異性体は化学的性質は同じで、光化学的性質のみが違います。
光化学的な性質は知らなくて良いので、1つの炭素に異なる4つの原子団が結合している炭素を持つかどうかを見れば良いのです。
①\(\,\mathrm{C_2H_3Cl}\,\)
エチレンの水素1つが塩素\(\,\mathrm{Cl}\,\)に置換されただけなので異性体はなく、
不斉炭素はありません。
②\(\,\mathrm{C_2H_4Cl_2}\,\)
異性体はありますが、不斉炭素はありません。
③\(\,\mathrm{C_2H_4BrCl}\,\)
\(\,\mathrm{Br}\,\)と\(\,\mathrm{Cl}\,\)が異なる2つの炭素に結合している場合と、
同じ炭素に結合している異性体が考えられます。
異なる炭素に結合している場合は不斉炭素はありませんが、
\(\mathrm{C\color{blue}{H_2}Br-C\color{blue}{H_2}Cl}\)
同じ炭素に結合したとき、1つの炭素に結合している4つ原子、原子団は異なります。
\(\mathrm{CH_3-C^*H\color{red}{Br}\color{blue}{Cl}}\)
\(\,\fbox{ 4 }\,\)の答え \(\,\underline{ ③ }\,\)
〔問5〕酢酸エチルの合成
エステルの合成です。
\(\hspace{10pt}\mathrm{CH_3-\color{red}{C}OOH+H\color{blue}{O}-C_2H_5 \\
\rightarrow CH_3\color{red}{C}(=O)-\color{blue}{O}-C_2H_5}\)
カルボキシ基の炭素とアルコールの酸素が結合することになります。
このサイト内ページの内容そのものが問題になっているので確認しておくと良いです。
\(\,\mathrm{a}\,\) 適当でないものを選びます。
酢酸エチルは水よりも比重が小さいので水溶液と混ぜると上層に分離します。
ほとんどの有機化合物は水と油の油側になるので、水と混ぜると水より軽い油(有機物)が浮きます。
\(\,\fbox{ 5 }\,\)の答え \(\,\underline{ ③ }\,\)
\(\,\mathrm{b}\,\) エステルの合成は有名なので詳しく説明するほどでもありませんね。
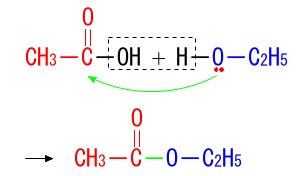 アルコール側の酸素がカルボニル炭素を求核(攻撃?)する形になります。
アルコール側の酸素がカルボニル炭素を求核(攻撃?)する形になります。
そのためエタノールの酸素はエステル側に付くので、生成する水の分子量は普通の水の分子量となります。
\(\,\fbox{ 6 }\,\)の答え \(\,\underline{ ① }\,\)
第5問高分子化合物とアミノ酸の性質
〔問1〕高分子化合物を生成する2つの単量体
高分子化合物の原料を選ぶ問題です。
\(\,\mathrm{a}\,\) ナイロン\(\,66\,\)
\(\,6,6-\,\)ナイロンとも呼ばれますが、原料の炭素数が\(\,6\,\)と\(\,6\,\)だから\(\,6,6-\,\)ナイロンです。
アジピン酸
\(\hspace{10pt}\mathrm{HO-\color{red}{C}(=O)-(\color{red}{C}H_2)_\color{red}{4}-\color{red}{C}(=O)-OH}\)
ヘキサメチレンジアミン
\(\hspace{10pt}\mathrm{H_2N-(\color{red}{C}H_2)_\color{red}{6}-NH_2}\)
\(\,\fbox{ 1 }\,\)の答え \(\,\underline{ ① }\,\)
b \(\,\mathrm{SBR}\,\)(スチレンブタジエンラバー)
その名の通り
スチレン \(\mathrm{C_6H_5-CH=CH_2}\)
ブタジエン \(\mathrm{CH_2=CH-CH=CH_2}\)
を原料として共重合される合成ゴムです。
\(\,\fbox{ 2 }\,\)の答え \(\,\underline{ ⑤ }\,\)
ここは名前と単量体が分かれば良いだけなので説明は必要ないですね。
〔問2〕アミノ酸の性質と等電点
アミノ酸は、
酸の性質を示すカルボキシ基\(\,\mathrm{(-COOH)}\,\)
と
塩基性を示すアミノ基\(\,\mathrm{(-NH_2)}\,\)
を両方持っているので\(\,\mathrm{pH}\,\)の値によって陽イオンと陰イオンの比率が変化します。
等電点では電荷は全体で\(\,0\,\)になり、陽イオン、陰イオン両方の性質を示し、
双性イオン
\(\hspace{10pt}\mathrm{R-CH(NH_3^\color{red}{+})(COO^\color{blue}{-})}\)
等電点より\(\,\mathrm{pH}\,\)が小さいとき、(\(\,\mathrm{H^+}\,\)イオンが多いとき)
陽イオン
\(\hspace{10pt}\mathrm{R-CH(NH_3^\color{red}{+})(COOH)}\)
等電点より\(\,\mathrm{pH}\,\)が大きいとき、(\(\,\mathrm{H^+}\,\)イオンが少ないとき)
陰イオン
\(\hspace{10pt}\mathrm{R-CH(NH_2)(COO^\color{blue}{-})}\)
が多く存在するように平衡が移動します。
\(\,\mathrm{A}\,\)のアミノ酸(グリシン)の等電点は\(\,6.0\,\)なので、
\(\,\mathrm{pH=6.0}\,\)のとき両性(双性)イオンとして存在しています。
\(\,\mathrm{B}\,\)のアミノ酸(リシン)の等電点は\(\,9.7\,\)なので、
\(\,\mathrm{pH=7.0}\,\)のとき陽イオン\(\,(\,+\,)\,\)
として存在しているので、陰極\(\,(\,-\,)\,\)側に移動します。
\(\,\fbox{ 3 }\,\)の答え \(\,\underline{ ⑥ }\,\)
第6問高分子化合物(選択問題)
選択問題ですが、どちらも計算問題があるので同じようなものですね。
〔問1〕高分子化合物の構造と性質
誤りを含むものを選びます。
①ポリエチレンには高密度ポリエチレンと低密度ポリエチレンがあります。
高密度ポリエチレンは枝分かれが少ないので鎖が密に並ぶことで強くなりますが透明度は低くなります。
低密度ポリエチレンが透明なポリ袋、高密度ポリエチレンがポリバケツ、と覚えておくと良いです。
②フェノール樹脂はフェノールとホルムアルデヒドを単量体として重合されます。
ポイントはフェノールの\(\,\mathrm{-OH}\,\)ではなく、オルト位とパラ位の水素がアルデヒドと反応するということです。
③⑤は正しいです。
④シス形のポリイソプレンは天然ゴムの成分です。
シス形が分子鎖が折れ曲がった形をしていて、不規則ですき間が多くできるので結晶化が余りこらず柔らかい物質です。
逆にトランス形のポリイソプレンは規則的で結晶化が起こりやすいので硬くなります。
\(\,\fbox{ 1 }\,\)の答え \(\,\underline{ ④ }\,\)
〔問2〕合成高分子の元素組成比の分析
問題の高分子化合物は2つの繰り返し単位があります。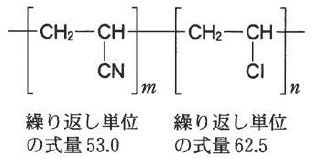 左の繰り返し単位の式量が\(\,53.0\,\)で、右の繰り返し単位の式量が\(\,62.5\,\)です。
左の繰り返し単位の式量が\(\,53.0\,\)で、右の繰り返し単位の式量が\(\,62.5\,\)です。
左の繰り返し単位が\(\,m\,\)個、
右の繰り返し単位が\(\,n\,\)個、
つながった(結合した)ものがこの高分子化合物の平均分子量なので、
\(\hspace{10pt}\color{red}{53\,m+62.5\,n=1.78\times 10^4 ・・・①}\)
また、
左の繰り返し単位には\(\,3\,\)個の炭素
右の繰り返し単位には\(\,2個\,\)の炭素
があるので、この高分子化合物全体には炭素原子が
\(\hspace{10pt}3m+2n\,(\,個\,)\)
塩素原子は右の繰り返し単位に1つだけなので、
塩素の原子数は\(\,n\,\)個
この炭素と塩素の物質量の比、つまり個数の比が\(\,3.5:1\,\)なので
\(\hspace{10pt}\color{blue}{(\,3\,m+2\,n\,):n=3.5:1 ・・・②}\)
\(\,\color{blue}{②}\,\)より
\(\begin{eqnarray}
3m+2n:n&=&3.5:1\\
3.5n&=&3m+2n\\
1.5n&=&2m\\
n&=&\color{magenta}{2m}
\end{eqnarray}\)
これを\(\,\color{red}{①}\,\)に代入して
\(\begin{eqnarray}
53\,m+62.5\,n&=&1.78\times 10^4\\
53\,m+62.5(\,\color{magenta}{2\,m}\,)&=&1.78\times 10^4\\
53\,m+130\,m&=&1.78\times 10^4\\
183\,m&=&1.78\times 10^4\\
m&≒&100
\end{eqnarray}\)
\(\,\fbox{ 2 }\,\)の答え \(\,\underline{ ② }\,\)
第7問天然高分子化合物(タンパク質)の構造と性質
高分子化合物(ポリペプチド)の構造と計算問題です。
〔問1〕ポリペプチドの構造
タンパク質はアミノ酸の配列順序となる\(\,1\,\)次構造から、
水素結合などの要因で\(\,2\,\)次、\(\,3\,\)次、\(\,4\,\)次構造と複雑な作りとなっていきます。
タンパク質のポリペプチド鎖において、
水素結合が同一分子内で多く形成され、
できる右巻きのらせん構造を\(\,\alpha-\,\)ヘリックス構造といいます。
これに対し、
平行に並んだポリペプチド間で水素結合が形成され、
波形になった構造を\(\,\beta-\,\)シート構造といいます。
①③④は正しいです。
\(\,\fbox{ 1 }\,\)の答え \(\,\underline{ ② }\,\)
〔問2〕マルトース(麦芽糖)の還元性と計算問題
デキストリンを加水分解してマルトースを得ます。
デキストリンの繰り返し単位は
\(\hspace{10pt}\mathrm{C_6H_{10}O_5}\\
=12\times 6+1\times 10+16\times 5\\
=72+10+80\\
=162\,\)
平均分子量が\(\,8.1\times 10^3\,\)であることから
\(\begin{eqnarray}
162\,n&=&8.1\times 10^3\\
n&=&\frac{8.1}{162}\times 10^3\\
&=&50
\end{eqnarray}\)
このデキストリンを\(\,\mathrm{(C_6H_{10}O_5)_{50}}\,\)とします。
元のデキストリンは\(\,1.0\times 10^{-3}(\,\mathrm{mol}\,)\,\)あったので
マルトース\(\,\mathrm{(C_6H_{10}O_5)_2}\,\)は
\(\hspace{10pt}\displaystyle 1.0\times 10^{-3}\times \frac{50}{2}\\
=\color{red}{2.5\times 10^{-2}}(\,\mathrm{mol}\,)\)
得られたと考えられます。
マルトース\(\,1\,\)分子には還元性を示すヘミアセタール構造は1つなので、
マルトースの物質量と生じる酸化銅\(\,\mathrm{(Ⅰ)Cu_2O}\,\)の物質量は同じなので
(\(\,\mathrm{Cu_2O=64\times 2+16=\color{blue}{144}}\,\)であることから)
生じる酸化銅\(\,\mathrm{(Ⅰ)Cu_2O}\,\)は
\(\hspace{10pt}\color{blue}{144}\times \color{red}{2.5\times 10^{-2}}\\
=3.6\,(\,\mathrm{g}\,)\)
\(\,\fbox{ 2 }\,\)の答え \(\,\underline{ ③ }\,\)
これで終わりです。
リンクは貼っていませんがこのサイト内に解説してあることがほとんどです。
キーワードでサイト内検索して確認してみておくと良いです。
説明を詳しくはしていませんが、基本的なことをまとめたこのサイト内で解決していることからも分かるように、出題されている範囲は広いですが基本中心に問題は作られていることが分かりますね。
⇒ 共通テスト(センター試験~)の化学と化学基礎の過去問解説
共通テストになっても同じです。