単に蒸気圧という場合飽和蒸気圧を示しますが、蒸気圧とはどのような状態の何の圧力なのか分かりますか?さらに蒸気圧曲線と沸点との関係も見られるようになっておきましょう。気液平衡については別に詳しく取り上げますがここでも用語は確認しておきます。
フタの無い容器を開放容器といいますが、液体を開放容器に入れておくと液体は徐々に減りいずれ無くなります。
これは液体表面で大きな運動エネルギーをもつ分子が分子間力を振り切って空間に飛び出すからです。
この現象が蒸発ですね。
蒸気圧(飽和蒸気圧)と気液平衡
フタのある容器を密閉容器といいます。
密閉容器に少量の液体を入れて温度を一定にすると、
最初のうちは液面から飛び出す(蒸発する)分子の数は一定ですが、
液面に衝突して液体にもどる(凝縮する)分子の数は時間とともに増加していきます。
これは気体中にある液体成分の気体が少ないから蒸発が起こりやすいということです。
しばらくすると、一定時間あたりに蒸発する分子と凝縮する分子の数が等しくなります。
このとき見かけ上は蒸発も凝縮も起こっていない状態になり、この状態を気液平衡といいます。
気液平衡になっている気体の示す圧力をその液体の蒸気圧または飽和蒸気圧といいます。
※気液平衡にあるとき見かけ上は蒸発と凝縮が止まって見えますが、
実際は蒸発する分子の数と凝縮する分子の数が等しくなっているだけで、
状態変化をしていないわけではありませんよ。
液体の蒸気圧は温度が上がるにつれて大きくなります。 一定の温度では液体の蒸気圧は液体の種類によって異なりますが、 体積を増加させるとその分蒸発が進み、体積を減少させると凝縮が進みやがて平衡に達するから蒸気圧は一定となるのです。 蒸気圧と温度との関係をグラフで表したものを蒸気圧曲線といいます。 液体の蒸気圧が液体の表面を押している大気の圧力に等しくなると、 一般に外圧(液面をおさえる圧力)が高いときは沸点は高くなり、外圧が低いときは沸点は低くなります。 沸騰するには「液体の蒸気圧」=「大気圧」となることが条件となります。 例えば上の蒸気圧曲線から、 ① 蒸発する分子と凝縮する分子の数が等しくなったときが気液平衡でその時に示す気体が示す圧力が蒸気圧(飽和蒸気圧)。 ② 蒸気圧は温度が一定なら液体の量や容器の体積およびその他の気体の有無には関係が無い。 ③ 液体内部から蒸気が発生し出す現象が沸騰。 ④ 液体の蒸気圧と大気圧とが等しくなる温度が沸点。 気体分子の熱運動と気体分子の圧力について 次は気体における圧力と体積の関係を見ます。 ここから法則がいくつか続きますが、最終的には1つになります。
気体の体積には関係なく一定です。
これは他の気体が共存していても変わりません。蒸気圧曲線
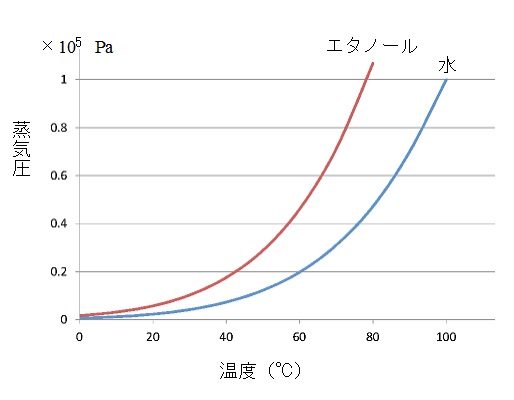
これは物質によって決まっています。蒸気圧と沸点との関係
液体表面だけでなく液体内部からも蒸気が発生し始めます。
この現象が沸騰であり、この温度を沸点といいます。
圧力鍋はフタをすることで外圧を高め、沸点を高くすることで液体の沸点を上げ、通常より高い温度で熱を伝え調理する器具ですね。
1気圧のときは水の沸点は100℃、エタノールの沸点は78℃ぐらいだと読み取れます。
1気圧より低いときはそれよりも沸点が低く、
0.8気圧だと水の沸点は93℃、エタノールの沸点は73℃くらいですね。
蒸気圧曲線からはこういったことが読み取れるのです。まとめ
⇒ 気体分子の熱運動と圧力の単位Pa(パスカル)と大気圧
で見ておいてください。