炭化水素には鎖式の脂肪族炭化水素と芳香族炭化水素があります。ベンゼン環を持つ炭化水素を芳香族炭化水素と分類しますが、ベンゼンそのものの構造と性質を知っておきましょう。構造式の書き方も構造異性体も独特です。
芳香族炭化水素
最初に書いたようにベンゼン環を持つ炭化水素を芳香族炭化水素といい、
代表的な物質にベンゼン、トルエン、キシレン、ナフタレンなどがありますが、芳香を持っているので芳香族といわれます。
芳香族炭化水素はすべてベンゼン環を持っているので、
先ずはベンゼンの性質を知っておく必要があります。
ベンゼンの構造と性質を見ていきましょう。
ベンゼンの構造と表記法
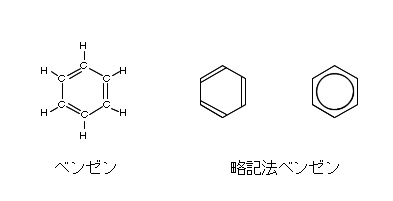
ベンゼン( \(\mathrm {C_6H_6}\) )は炭素原子6個と水素原子6個が同一平面上に六角形をなす環式の炭化水素です。
構造式は二重結合と単結合を交互に書いて表します。
ベンゼンの環状構造は発見者の名前にちなんでケクレ構造といいますが、
6個の炭素に性質的な違いはなく、
二重結合と単結合の中間的な状態になっているので、
炭素や水素を省略した略記法で表されることが多いです。
※
ケクレ(ドイツ)はベンゼンの構造を二重結合と単結合の位置がたえず入れかわり中間的な性質を示すと考えましたが、現在では二重結合が移動するのではなく、全部の炭素原子が二重結合と単結合の中間的な結合をしていることが分かっています。
※※
高校の化学では炭素と水素を省略して表記するのはベンゼン環だけですが、大学では脂肪族の炭化水素でも省略することが多いです。
ベンゼンの性質
特有の臭いのある無色の液体で水には溶けにくいです。
以前は有機溶媒として広く使われていましたが、毒性が強いので現在では少し毒性の低いトルエンやキシレンが使われています。
空気中で燃やすとすすを多量に出しながら燃えます。
芳香族化合物を合成するときの原料となります。
特殊な条件下でなければ付加反応は起こりにくく、
水素が置換される置換反応がほとんどです。
ベンゼン置換体の異性体
1つの水素が置き換わった一置換体には異性体は存在しません。
二置換体以上の物質に異性体が存在して置換基が配置される位置によって、
オルト(\(o-\))、メタ(\(m-\))、パラ(\(p-\))
の3種類があります。
置換基二個の位置関係は、
オルトは隣同士に位置したとき、
メタは1つ離れて位置したとき、
パラは反対に位置したとき、
となります。
※
IUPAC名では化合物の主体となる置換基がついた炭素の位置を「1」として右回りに番号をつけていきますので、
\(o-\) オルトは「1,2-」、
\(m-\) メタは「1,3-」、
\(p-\) パラは「1,4-」となりますね。
例えば、ベンゼンの水素を1つメチル基に置きかえたものがトルエンですが異性体はありません。
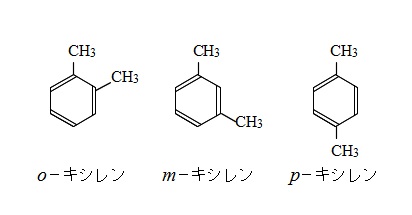
2つメチル基に置きかえたものがキシレンですが構造異性体が3種類存在します。
\(o-\)キシレン、\(m-\)キシレン、\(p-\)キシレンの3種類です。
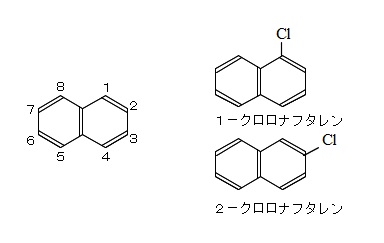
ベンゼン環が2個並んだ構造をしているナフタレンには一置換体に構造異性体が2種類存在します。
この場合は置換基がついている炭素番号で区別するので注意しておきましょう。
環が結合している横の炭素が「1」で右回りに番号をつけていきます。
置換基が1つの場合は1,4,5,8の位置はひっくり返せば同じになり、
2,3,6,7もひっくり返せば同じになるので、
1か2の2種類の異性体ということになりますね。
※
主となる置換基によって \(o-\)、\(m-\)、\(p-\) の異性体の発生比率は違ってきます。
配向性というのですが今は、ベンゼンの二置換体には3種類の構造異性体があることは覚えておきましょう。
次はベンゼン環の反応を見てみましょう。
反応が起こりやすいのは付加反応なのか、置換反応なのかはっきりしています。