物質が固体、液体、気体の3つの状態で存在することを物質の三態といいますが、この状態変化をするときのエネルギーの関係とそれを図にした状態図について見ておきましょう。基礎化学的な部分もありますが試験でも良く聞かれるところです。
物質の状態変化
物質を加熱すると構成粒子の熱運動が激しくなり固体、液体、気体と状態が変わる。
この物質の三態での変化を状態変化というのは基礎化学の分野でも説明しましたが、改めて図にして説明しておきます。
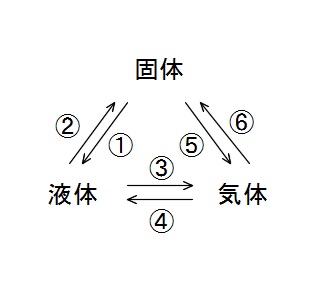
まとめてしまうと分かりにくくなるのですが、
この図が書ければ状態変化の内容は理解できているということになります。
自分で固体、液体、気体と書いて、
それぞれの変化の名前を書き込めるかチェックしてください。
①は「融解」②は「凝固」です。
純物質ではこの状態変化が起こる温度が同じで「融点」または「凝固点」といいます。
③は「蒸発」④は「凝縮」です。
⑤⑥は固体から液体を経由せず直接気体になること、またはその逆で「昇華」といいます。
状態変化とエネルギー
物質の状態が変化するときは物質粒子の熱運度に変化が起こるので必ずエネルギーの出入りがあります。
この状態変化とエネルギーにはいろいろと名前があるので覚えておきましょう。
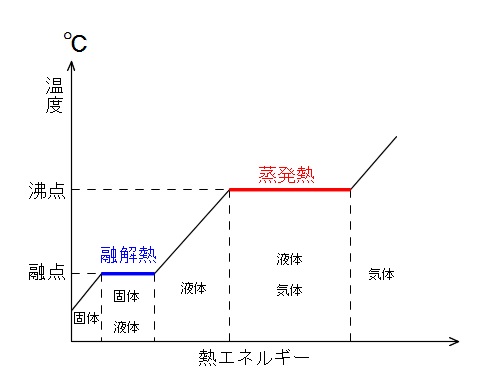
融解熱(ゆうかいねつ)
固体1molが、融点に達してから液体になるまでに外部から吸収する熱量を融解熱といいます。
融点に達して固体と液体が混じりだしてから完全に液体になるまでの熱量です。
沸点
液体の表面からの蒸発ではなく、
液体内部からも蒸発が起こることを「沸騰(ふっとう)」といい、
この沸騰の起こる温度を沸点といいます。
蒸発熱
液体1molが、沸点に達してから気体になりきるまでに外部から吸収する熱量を蒸発熱といいます。
一般的にですが沸点以下での蒸発熱は多少かわりますので沸点での値を示します。
同じ物質で融解熱と蒸発熱をくらべると、蒸発熱の方が大きいです。
\((融解熱) \color{red}{<} (蒸発熱)\)
状態図と三重点
温度を横軸、圧力を縦軸にとって、
物質が固体、液体、気体のどの状態で存在するかを図で示したものを「状態図」といいます。
温度の単位は℃、圧力はPa(\(\mathrm \times 10^5Pa\))とするのが普通です。
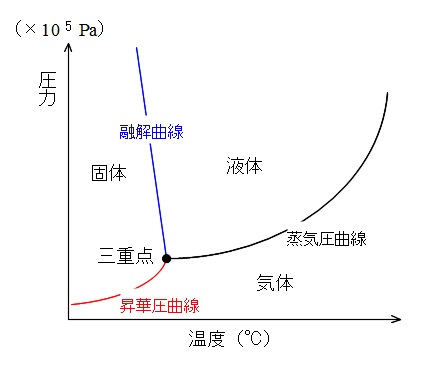
この状態図は三つの状態を3本の曲線で区切るのですが、
固体と液体の境界線を「融解曲線」
液体と気体の境界線を「蒸気圧曲線」
固体と気体の境界線を「昇華圧曲線」
とそれぞれ名前がついています。
境界線上ではどうなっているのか?と疑問に思うかもしれませんが2つの状態が共存しています。
そして、3本の曲線の交点を「三重点」といい、3つの状態が共存しているのです。
この状態図にはそれぞれ具体的な温度や圧力が入るため、
液体状態に保つ最低圧力や昇華する温度なども見て取ることができます。
物質の三態については基礎化学でも取り上げているので
で復習しておくと良いですね。
何度やっても忘れるのが普通ですから。
次は三態のひとつ「気体」の状態を見ていきましょう。
これから化学計算で使う気体の圧力の単位が決められます。