イオン結合でできる物質はいくつも規則的に並んだ繰り返し構造をしているので一部を代表して組成式という表し方をすることは別の記事でお伝えしました。
ここでは共有結合による分子とそれを表す分子式について見てみましょう。
分子式
普通に分子と読んでいるのは2つ以上の原子が結合した粒子のことをいいます。
分子を表すのに構成元素の種類とその数を右下にそえて書いた化学式を分子式といいます。
\( \mathrm {H_2}\) は水素分子を表します。水素原子が2つセットになって安定した水素の分子になると言う意味ですね。
この場合原子2つで分子を構成するので2原子分子といいます。
\(\mathrm {O_2}\)(酸素)や \(\mathrm {N_2}\)(窒素)なども2原子分子です。
\(\mathrm {H_2O}\) は水分子を表しますが、水素原子2つと酸素原子1つがセットになり安定した分子になります。
この場合は原子が3つ以上の分子になるので、多原子分子といいます。
\(\mathrm {NH_3}\)(アンモニア)や \(\mathrm {CO_2}\)(二酸化炭素)などが多原子分子です。
※
水素や酸素などの気体は原子1個では不安定で存在できないので2原子分子をつくって安定に存在しています。
しかし、原子1つで安定して存在できる分子も存在していて、ヘリウムやネオンなどの希ガスは原子1個で安定に存在できます。
このような分子を単原子分子といいます。
共有結合
原子どうしが価電子を1つずつ出し合い2つの電子を共有しあう結合を共有結合といいます。
共有結合をした各原子は安定な希ガスと同じ電子配置になって分子を作ります。
例えば、
水素原子は価電子を1つ持っていますが2つの原子が価電子を共有してヘリウムと同じ2つの価電子を持ち安定します。
このことは共有結合の電子の対(つい)を点で表すと分かり易いです。
電子式
最外殻電子を元素記号の周りに点(・)で示した式を電子式といいます。
電子式において電子が2つ対になっているものを電子対(でんしつい)といい、
対になっていない電子を不対電子(ふついでんし)といいます。
例えば、水素原子にある最外殻電子は不対電子です。
塩素の電子が2つセットになっていない価電子も不対電子です。
これらの不対電子どおしがセットになって電子対をつくり共有(きょうゆう)結合するのです。
図で見た方が分かり易いので図にしてみます。
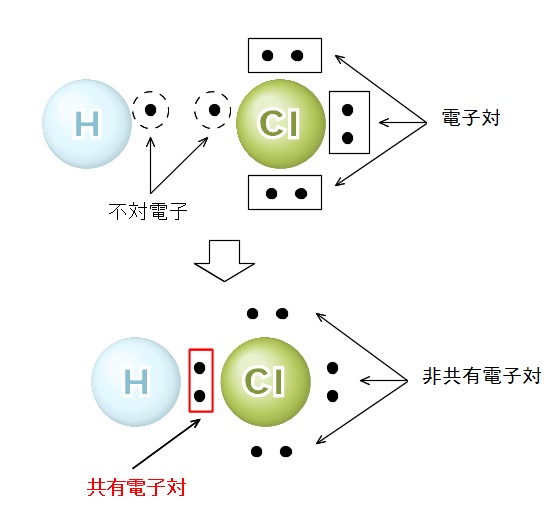
図を見た上で、もう一度説明します。
結合しようとする原子が不対電子を出し合って電子対をつくる結合を共有結合といいます。
この2つの原子は互いにその電子対を共有しています。
分子の電子式で2つの原子で共有されている電子対を共有電子対といい、共有されていない電子対を非共有(ひきょうゆう)電子対といいます。
つまり原子、分子の価電子を分類すると、
・対になっていない単独の価電子を不対電子
・2つの原子で共有されている電子対を共有電子対
・共有されていない電子対を非共有電子対
となりますね。
言葉で覚えるより電子式を書いて用語も同時に覚えた方がはやいですよ。
何故電子は2つで対になるのか?
水素やヘリウムのように原子番号の小さい原子以外の原子は価電子が8つあります。
この8つの電子は4つの組みに別れます。
電子式では分かり易いように元素記号の周りに4つに分けて電子を書いていきますがこの4つの組はそれぞれ電子が2個入ると安定するんです。
ですが、電子を入れていくのは4つの組みに先ずは1つずつ入れます。
5個目からの電子が対を作るということです。
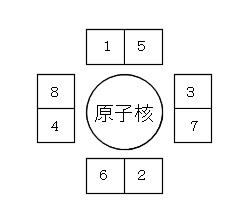
電子が入る順番は、
1,2,3,4に1つずつ入り、その後5,6,7,8の順で入ります。
5から後は対になるので安定します。
例えば酸素の価電子は6個ありますが、
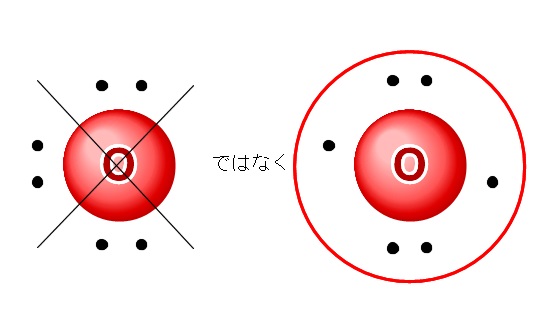
左のように3組の電子対ではなく、右のような周りに4つ電子が入った後2つが入る、という順番で入ります。
対になった方が安定なのに何故?
と思うでしょうが、対になる前に4つに分けて1つはいる方が楽なのです。w
ややこしいでしょうから電子軌道の話は後回しで良いですよ。
この後構造式を価標で表す方法をお伝えしますが、
価電子はやはり大切になりますので、
で復習しておいてください。