イオン結合でできている物質(イオン結晶)を化学式で表す場合、構成イオンの種類と構成しているイオンの数を最も簡単な比を使って組成式という表し方をします。分子式と何が違うのか?組成式の書き方の基本的なことをおさえておきましょう。
組成式
イオンでできている物質では分子が存在しません。だから分子式はありません。
その代わり、構成するイオンの種類とその割合をもっとも簡単な整数比で表した式、「組成式」で表されます。
分子については別のところで説明しますが、
気体の酸素( \( \mathrm O_2\) )や二酸化炭素 ( \( \mathrm {CO_2}\) )は2つの原子、3つの原子で1つの分子として存在していますが、塩化ナトリウムや硫酸カルシウムは1つひとつが個別に存在しているのではなく、いくつもまとまって存在しているのです。
だから構成単位を抜き出し、代表の形ということで組成比を簡単にした組成式で表します。
分子は単独で存在するから分子式。
イオン結晶はたくさん集まっているので代表を組成式で表しているということです。
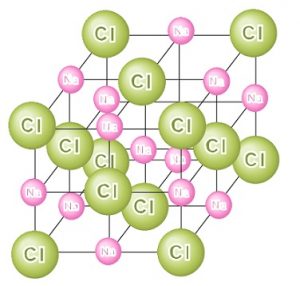
(こういう書くのに面倒なイメージ図は教科書で確認して欲しいのですが)笑
結晶構造を学んでからイメージを取りながらもう一度もどって復習すると分かりやすいかもしれません。
組成式の作り方と書き方
イオンからできる物質の組成式を表すときは化合物全体で電気的に中性になるように比率を決めます。
陽イオンと陰イオンの組み合わせなので、陽イオンの価数と陰イオンの価数によって変わります。
陽イオンが1価、陰イオンが1価のときは1:1です。
ナトリウムは1価の陽イオン( \( \mathrm {Na^+}\) )で+1、
塩素は1価の陰イオン( \( \mathrm {Cl^-}\) )で-1、
になります。
だから1:1のとき電荷は全体で、1×(+1)+1×(-1)=0(中性)
塩化ナトリウムの組成式は、\( \mathrm {NaCl}\)
陽イオン2価、陰イオンが1価のときは1:2です。
カルシウムは2価の陽イオン( \( \mathrm {Ca^{2+}}\) )で+2、
塩素は1価の陰イオン( \( \mathrm {Cl^-}\) )で-1、
になります。
だから1:2のとき電荷は全体で、1×(+2)+2×(-1)=0(中性)
塩化カルシウムの組成式は、\( \mathrm {CaCl_2}\)
になります。
先に組成式を示しましたが、
陽イオンを先に、その後ろに陰イオンを書きます。
その元素の右下に比率を示しますが1は省略します。
陽イオンと陰イオンの比は、
塩化ナトリウムの組成は1:1で \( \mathrm {NaCl}\)
水酸化カルシウムの組成は1:2で、\(\mathrm {Ca(OH)_2}\)
硫酸ナトリウムの組成は2:1で、\(\mathrm {Na_2SO_4}\)
硫酸カルシウムの組成は1:1で、\(\mathrm {CaSO_4}\)
硫酸アルミニウムの組成は2:3で、\(\mathrm {Al_2(SO_4)_3}\)
水酸化物イオンや硫酸イオンのような多原子イオンは(カッコ)でくくり右下にその数を書きます。
組成式の読み方
組成式を読むとき日本語では後ろの陰イオンから読みます。陽イオンが後です。
上の組成式の名称のようにです。
組成式の右下に書いた数字は読みません。組成元素名だけ読めば良いと言うことです。
結晶構造も説明しますが、
⇒ イオンの分類と価数とイオン式
の方が優先順位は上ですのでしっかり復習してください。
イオンの価数は周期表から推測出来るものが多いです。
少なくとも20番までの元素の周期表は変えるようにしておきましょう。