身の回りにある物質は共有結合で出来ているものが多くありますが共有結合の種類と分子の形はどういう関係になるのか、また分子をつくる共有結合でできる結晶にはどのようなものがあるのか基本的なことをお伝えします。
分子の形
分子の形は構成元素(原子)や共有結合の種類である単結合、二重結合、三重結合の組み合わせで変わってきます。
例を見てみましょう。
例えば、
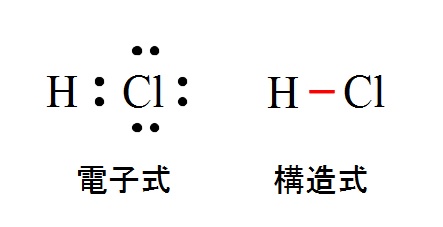
塩化水素( \( \mathrm {HCl}\) )は共有電子対を1組み持ち価標1本で結ばれている構造をしています。
もちろん2つしか原子がないので直線です。
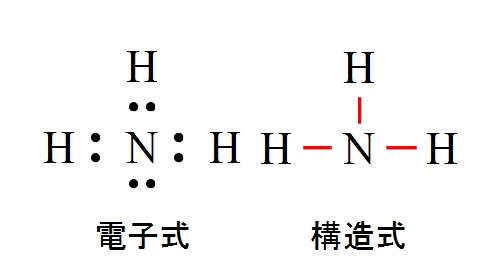
アンモニア( \( \mathrm {NH_3}\) )は窒素が不対電子を3つ持ち、それに水素が3つ結合するので価標は3本になります。
構造式は立体構造までは示さなくて良いですが、アンモニアは実は四面体(三角錐)構造をしています。
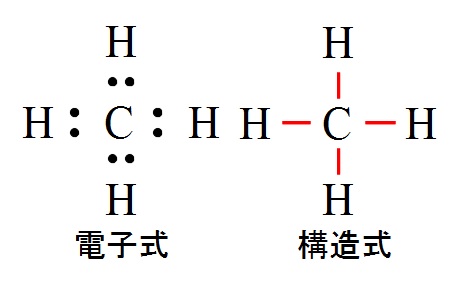
メタン( \( \mathrm {CH_4}\) )は炭素の4つの不対電子に対し、水素が4つ結合するので価標は4本です。
これも平面ではなく正四面体構造となります。
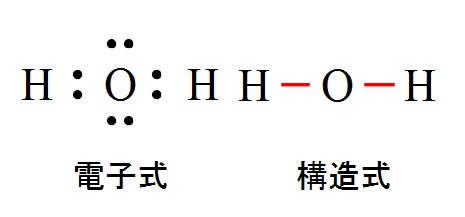
水( \( \mathrm {H_2O}\) )は酸素の2つの不対電子に水素が2つ結合したものですが、これは直線ではなく折れ線型になります。
二酸化炭素( \( \mathrm {CO_2}\) )は炭素の4つの不対電子に、酸素2つが二重結合する直線構造です。

窒素( \( \mathrm {N_2}\) )は窒素の3つの不対電子どうしが三重結合をつくります。
どう考えても直線ですね。w

※先の話になりますが、
たくさんの原子で分子をつくるときの立体構造は、
三重結合は次の原子まですべて直線です。 \(\mathrm{-C≡C-}\) など。
二重結合は二重結合部分で直線、次の原子とで平面をつくるように手を伸ばします。
単結合はいろいろな形で結合し回転するので決まった形とはなりません。
詳しくは有機化学分野のときに学びますのでその時までは気にしなくても良いです。
構造式は立体的な構造まで示さなくて良いので今は平面で気楽に書いてなれましょう。
共有結合結晶
イオン結合結晶については別の記事
⇒ イオン結合とは?クーロン力とイオン結晶の性質
にありますので参考にして下さい。
炭素( \(\mathrm C\) )やケイ素( \( \mathrm {Si}\) )は原子価が大きく(両方とも4価)、多くの原子が共有結合して結晶を構成しています。
ダイヤモンドや黒鉛やケイ素(結晶)などのような結晶です。
このような結晶を共有結合結晶といいます。
炭素だけでなる結晶にダイヤモンドと黒鉛のような同素体がありますね。
これらの違いは立体的につながるか、平面上につながるかの違いによってできるのです。
ダイヤモンドは4個の価電子を共有結合に使って立体網目構造をつくります。
黒鉛は3個の価電子を共有結合に使って平面構造をつくり、平面どうしが弱い引力で引き合っている結晶です。
共有結合結晶の性質
共有結合結晶は非常に硬いです。
電気を通さないものが多く、融点は非常に高いのが特徴ですね。
でも、ダイヤモンドは炭素なので燃えますよ。w
金やプラチナは燃えません。酸化もされません。
永遠の輝きといわれるダイヤモンド。
燃えると金やプラチナは残りますがダイヤモンドはなくなりますのでご注意下さい。笑
共有結合が理解できたら
結合の強さによって結合の種類が分けられることが理解できます。