カルボン酸はアルデヒドを酸化することで生成します。酸というくらいなので酸性を示しますが、還元性を示すものもあります。カルボキシ基を2つ持つ幾何異性体のマレイン酸とフマル酸についての性質の違いと覚え方を知っていますか?
カルボン酸とは
分子内の官能基にカルボキシ基( \(\mathrm{-\color{red}{COOH}}\) )を持つ化合物をカルボン酸といいます。
カルボキシ基は構造式を見るとヒドロキシ基(水酸基)を離してアルカリ性を示すように見えますが水素を離して弱い酸性を示します。
\(\mathrm{R-CO-OH} → \mathrm{R-CO-O^\color{red}{-}} + \mathrm{\color{red}{H^+}}\)
弱い酸性ですが炭酸よりは強い酸性です。
1価カルボン酸
分子内にカルボキシ基を1つ持つカルボン酸を1価カルボン酸、またはモノカルボン酸といいます。
例えばギ酸( \(\mathrm {HCOOH}\) )や酢酸( \(\mathrm {CH_3COOH}\) )などがモノカルボン酸です。
鎖式炭化水素である脂肪族の1価のカルボン酸を「脂肪酸」ということもありますので覚えておきましょう。
低級脂肪酸:炭素鎖の短い(炭素数の少ない)脂肪酸
高級脂肪酸:炭素鎖の長い(炭素数の多い)脂肪酸
2価カルボン酸
分子内にカルボキシ基を2つ持つカルボン酸を2価カルボン酸、またはジカルボン酸といいます。
例えば、
シュウ酸( \(\mathrm {(COOH)_2}\) )やマレイン酸、
フマル酸( \(\mathrm {COOHCH=CHCOOH}\) )などがジカルボン酸です。
マレイン酸とフマル酸は幾何異性体なので呼び名は違いますが示性式は同じです。
カルボン酸の反応性
高級脂肪酸は水に溶けにくいですがカルボキシ基の反応性が高く、塩基性の水溶液とは中和反応を起こし塩をつくるので溶けやすいです。
\(\mathrm{RCOOH} + \mathrm{NaOH} → \mathrm{RCOONa} + \mathrm{H_2O}\)
また、カルボン酸より弱い酸の炭酸水素塩の水溶液とは塩を生じて、二酸化炭素を発生させながら溶けます。
酸とそれより弱い酸の塩とは反応が起こり、より弱い酸を遊離するからですね。
\(\mathrm{CH_3COOH}\,+\,\mathrm{NaHCO_3} → \mathrm{CH_3COONa}\,+\,\mathrm{H_2O}\,+\,\mathrm{CO_2}\)
それではカルボン酸の性質を個別に見てみましょう。
ギ酸の生成と反応
ギ酸 \(\mathrm{\color{red}{HCOOH}}\)
メタノールを触媒を用いて酸化するとホルムアルデヒドを経由してギ酸が生成しますが、
\(\mathrm{CH_3OH} → \mathrm{HCHO} → \mathrm{HCOOH}\)
工業的には水酸化ナトリウムの粉末に高温高圧で一酸化炭素を反応させてギ酸ナトリウムを生成させ、さらの希硫酸を加えて得られます。
\(\mathrm{NaOH} + \mathrm{CO} → \mathrm{HCOONa} → \mathrm{HCOOH}\)
ギ酸は「蟻酸」と書くくらいで蟻(あり)の体内にある酸で毒性があります。
無色ですが刺激臭のする液体です。
構造式を見ると分かりますが、カルボン酸でありながらアルデヒド基も持つので還元性を持っていて銀鏡反応を示します。
ただし、フェーリング反応は起こりにくいです。(銅イオンとのキレート化)
酢酸の生成と反応
酢酸 \(\mathrm{\color{red}{CH_3COOH}}\)
アセチレンに水を付加させる、またはエタノールを酸化するとアセトアルデヒドが生成します。
\(\mathrm{CH\equiv CH} + \mathrm{H_2O} → \mathrm{CH_3CHO}\)
\(\mathrm{C_2H_5OH} → \mathrm{CH_3CHO}\)
アセトアルデヒドをさらに酸化させると酢酸が生じます。
\(\mathrm{CH_3CHO} → \mathrm{CH_3COOH}\)
酢酸は食酢でなじみがあると思います。食酢は酢酸の4%~5%の水溶液です。
無色で刺激臭がありますよね。原液はもっとすごいです。笑
温度が下がると原液に近いものは凍ります。
なので高純度の酢酸は氷酢酸と呼ばれます。
ちなみに酢酸の融点は17℃なので酢酸自体は日本の冬は沖縄以外凍るということですね。
水溶液にすることで凝固点降下が起こるので食酢は凍りません。
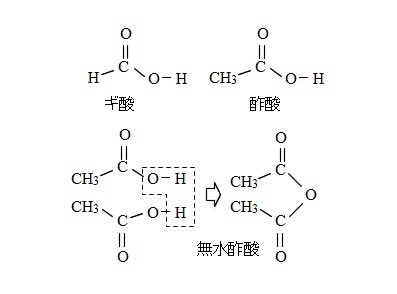
また、酢酸は塩化ホスホリル( \(\mathrm{POCl_3}\) )などの脱水剤と加熱すると、
酢酸2分子から水がとれて(縮合して)無水酢酸を生じます。
このような化合物は酸無水物と呼ばれます。
\(\mathrm{2CH_3COOH} → \mathrm{(CH_3CO)_2CO} + \mathrm{H_2O}\)
氷酢酸と無水酢酸は別物なので注意しておきましょう。
「氷酢酸」は純度の高い酢酸で、「無水酢酸」は酢酸2分子から脱水した酸無水物です。
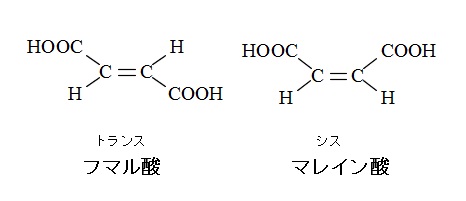
マレイン酸とフマル酸
代表的な不飽和ジカルボン酸に \(\mathrm{HOOC-CH=CH-COOH}\) があります。
幾何異性体が存在していてシス形とトランス形があるのですが呼び名が違っていて、
シス形がマレイン酸、トランス形がフマル酸です。
遠い昔(虎に踏まれて希に死す)と覚えた記憶があります。笑
シス形のマレイン酸はカルボキシル基が同じ側にあるので分子内脱水して無水マレイン酸になります。
トランス形のフマル酸は加熱しても無水フマル酸とはなりません。
トランス形はカルボキシ基が遠いので酸無水物にはなりにくいです。
ただし、不飽和結合を切るほどの条件下では脱水します。
でも生成物は無水フマル酸ではなく無水マレイン酸です。
ちょっと長くなるのでやめておきます。
詳しく知りたい場合は参考書などで調べるか、学校の先生に聞いてください。
ここでは基本をおさえて先に進みます。
カルボン酸についての基本的な性質を書きましたが、
アルコールを酸化するとアルデヒドになり、
アルデヒドを酸化するとカルボン酸になる。
これだけは誘導体の流れとして覚えておきましょう。
アルデヒドは
⇒ アルデヒド基の性質 銀鏡反応とフェーリング反応
で見ておいてください。
次はカルボン酸とアルコールから脱水します。
脱水する水はカルボン酸とアルコール、どちらから何がとれるかわかりますか?