エステル結合はカルボン酸とアルコールの脱水縮合で生成します。示性式より構造式で見ると分かり易いので生成段階から見てみましょう。エステルは加水分解するとカルボン酸とアルコールにもどります。その仕組みも見ておきましょう。
エステル
カルボン酸 \(\mathrm{R-COOH}\) とアルコール \(\mathrm{R’-OH}\) から、
水1分子がとれてできる化合物 \(\mathrm{R-COO-R’}\) をエステルといい、
結合部分の \(\mathrm{\color{red}{-COO-}}\) をエステル結合といいます。
\(\mathrm{R-COOH} + \mathrm{R’-OH} → \mathrm{R-COO-R’} + \mathrm{H_2O}\)
このように2つの分子から水がとれて結合することを縮合(脱水縮合)といいます。
エステル生成の例
ギ酸メチル
\(\mathrm{HCOOH} + \mathrm{CH_3OH} → \mathrm{HCOOCH_3} + \mathrm{H_2O}\)
酢酸エチル(接着剤の臭い)
\(\mathrm{CH_3COOH} + \mathrm{C_2H_5OH} → \mathrm{CH_3COOC_2H_5} + \mathrm{H_2O}\)
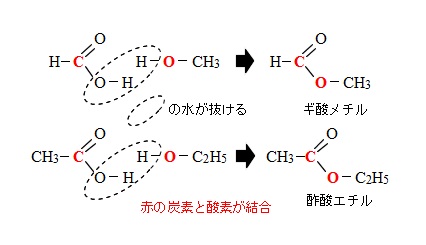
カルボン酸の酸性を示すのは水素なので、
カルボン酸側の水素が抜けていきそうな気がしますが、
実はアルコールの酸素がカルボキシ基の酸素についている炭素を求核する反応なのでカルボキシ側の炭素-酸素の結合が切れます。
(上に図で示してあります。)
名前が似ていますがエステル \(\mathrm{R-COO-R’}\) とエーテル \(\mathrm{R-O-R’}\) を間違えないでくださいね。
エステルの性質
炭化水素部分が増えてきますので水には溶けにくくなってきますが、逆に有機溶媒には良く溶けるようになります。
異性体の関係になるカルボン酸よりもエステルの融点、沸点は低いです。
ギ酸エチルや酢酸エチルのように低分子量のものは果実のような芳香を持っていて常温では液体です。
エステルの酸による加水分解
酸を加えて加熱すると加水分解します。
カルボン酸とアルコールにもどるものも出てくるということです。
\(\mathrm{RCOOR’} + \mathrm{H_2O} \rightleftharpoons \mathrm{RCOOH} + \mathrm{R’OH}\)
エステルの塩基による加水分解(けん化)
塩基性水溶液を加えて加熱しても加水分解が起こりますがカルボン酸は塩(アルカリ塩)になります。
特にこの塩基によるエステルの加水分解を「けん化」といいます。
⇒ 油脂の種類とセッケンの製法(けん化)と合成洗剤(界面活性剤)
この場合は可逆反応とはいえません。
\(\mathrm{RCOOR’} + \mathrm{NaOH} → \mathrm{RCOONa} + \mathrm{R’OH}\)
補足
硝酸のようなオキソ酸(非金属の酸)もアルコールと縮合してエステルをつくります。
例えば硝酸と硫酸の混合溶液とグリセリンを混ぜて低温で反応させるとダイナマイトの原料となるニトログリセリンが生成します。
この場合はニトロ基が炭素についていないのでニトロ化合物ではなくエステルに分類します。
\(\mathrm{R-O-H} + \mathrm{HO-NO_2} → \mathrm{R-O-NO_2}\)
とれる水はこの場合もアルコール側は水素です。
硝酸側の \(\mathrm{OH}\) がとれます。
よく見る基本的な官能基を一通り見てきました。
ここまでがちょっとした区切りになります。
官能基のところでも触れていますが、化学反応する部分はほとんどが官能基です。
どのような官能基があったか確認しなおしておくと良いです。