酵素という言葉は良く聞きますがいったい何なのか?構成している物質と特定の物質にだけ作用する基質特異性や温度などによる働きの違いを化学的に見ておきましょう。種類は数千にもなりますのですべてを覚える必要はありません。
酵素とは?
酵素は生体内で触媒としてはたらいています。
触媒というと白金や酸化マンガンなどの無機触媒を想像するでしょうけど酵素は有機物です。
タンパク質からできていて酵素1つひとつが重要な役割を持っています。
基質特異性
酵素は無機触媒よりも強力な触媒作用を示しますが特定の物質にしか作用しません。
この働きかける特定の相手物質を「基質」といいます。
そして酵素のこの限定的な働き、基質の選択性を基質特異性というのです。
例えば、アミラーゼはデンプンを麦芽糖に分解する酵素です。
他にもスクラーゼ(インベルターゼ)はスクロースを加水分解しますが他の二糖類には全く反応しません。
酵素はタンパク質でできているため立体構造を持っていますが、その立体構造が一定の構造をしているのです。
この基質と作用する特定の構造部分を「活性部位」といい、「活性中心」とも呼ばれます。
基質と酵素はしばしば「鍵」と「鍵穴」で例えられますね。
基質と酵素が一体になって活性化されるのですがこの複合体を「酵素基質複合体」といいます。
複合体から基質が分解されて離れたりしても、酵素は複合体になる前のもとのままで変わりません。
そのため触媒としてはたらいているということです。
酵素は触媒作用が強いですが、タンパク質でできているため熱や酸や塩基や光に対しては弱い面がありますので覚えておいてください。
最適温度
酵素にはそれぞれ最もよく働く温度があります。
この温度を「最適温度」といいます。
おおよその酵素では最適温度は体温である35℃~40℃くらいと覚えておいて良いです。
温度が高い方が活性化するのではないかと思うかもしれませんが、酵素はタンパク質でできています。
おおよその酵素では60℃を超えると変性してしまうので酵素の活性を失います。
これを「酵素の失活」といいます。
※
温度を上げて変性して失活した酵素は温度を下げても復活しませんが、
低温で失活した酵素は温度を上げることで活性を取り戻します。
失活する要因が金属イオンの場合は活性を低下させるものと、
完全に失活させる有毒なものがありますので注意が必要です。
詳しく知りたい場合は生物関連の書物を参考にするといいでしょう。
最適pHとは
酵素の活性はpHによっても変わります。
中性であるpHが7付近で最も活性化する酵素が多いですが、
この最も活性化するpHを最適phといいます。
例外ももちろんあります。
胃液である酵素のペプシンはpHが2くらいが最適pHです。
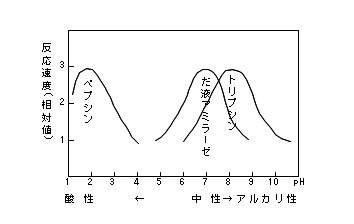
※
最適温度も最適pHも一点だけで活性するので無く、山型になったピークを持つ活性曲線となります。
例えばアミラーゼはpH=5くらいから山の頂点をpH=7としてpH=9くらいまでの曲線となります。
補酵素
酵素の活性は酵素単独で決まるのではないことは最適温度や最適pHを見ても分かると思いますが、ビタミンや低分子の有機化合物も関係しています。このように酵素の働きを助ける物質を補酵素といいます。
補酵素は酵素と比較すると熱に強いですね。
酵素の種類
酵素の種類は非常に多く、人の場合でも3000種類くらいあります。
働きによって大きく6種類に分けると、
加水分解酵素(ヒドロラーゼ)
酸化還元酵素(オキシドレダクターゼ)
脱離酵素(リアーゼ)
合成酵素(リガーゼ)
転移酵素(トランスフェラーゼ)
異性化酵素(イソメラーゼ)
に分けることができますが、覚えなくて良いです。笑
加水分解酵素の具体的な酵素の基質と生成物をあげておきますのでこちらを覚えて下さい。
アミラーゼ : デンプン → マルトース
マルターゼ : マルトース → グルコース
スクラーゼ(インベルターゼ) : スクロース → グルコースとフルクトース
セルラーゼ : セルロース → セルビオース
リパーゼ : 油脂 → 脂肪酸とグリセリン
ペプシン : タンパク質 → ペプチド
トリプシン : タンパク質 → ペプチド
ペプチターゼ : ペプチド → アミノ酸
生物でも習うとは思いますが化学でも覚えておくと良いかもしれませんね。
酵素はタンパク質でできた触媒です。
アミノ酸からペプチド、そしてタンパク質が構成されているということは忘れないでください。
⇒ アミノ酸の種類と構造と性質(ニンヒドリン反応)
のアミノ酸の基本と性質と
⇒ ペプチド結合とタンパク質の構造と性質
の復習は必須ですよ。