元素は大きく分類すると典型元素と遷移元素に分けられます。これまで典型元素についていろいろと書いてきましたが、ここでは遷移元素の特徴と性質をまとめておきます。元素名をあげて説明しますが先ずは周期表の確認からになります。
遷移元素
周期表は1族から18族までありますが、
1,2族と13族~18族の元素を典型元素といい、
間の3族から12族までの第4周期以降の元素を遷移元素といいます。
(第3周期までは3族から12族までの元素はありません。)
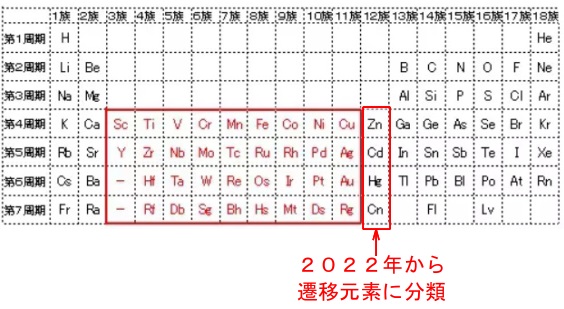
※
2022年から12族は数十年ぶりに遷移元素になりました。
持っている教科書によって違うので注意しておいて下さい。
「なおしたまえ」というご指摘を頂きましたので訂正しておきます。
※※
亜鉛はもともと遷移元素に似た性質を持っています。
分類は変わっても性質は変わらないので亜鉛や個々の元素に対する認識は変えなくて良いです。
典型元素の電子配置は原子番号が増加すると、最外殻へ電子が配置されるので価電子が1つずつ増えます。
そのため周期表の縦、つまり同族元素での性質が似ています。
例えば、周期表で縦に並んだ
\(\,\mathrm{F(フッ素)\,,\,Cl(塩素)\,,\,Br(臭素)\,,\,I(ヨウ素)}\,\)
などのハロゲンは性質が似ています。
ところが、
遷移元素では原子番号が増加しても、最外殻に電子が配置されるのではなく、まだ空いている内側の電子殻に電子が配置され、価電子は1個か2個のままでいる方が安定します。
そのため周期表で横に並んだ元素どうし、つまりは同周期元素の性質が似ています。
繰り返します。
典型元素は同族元素どうしで性質が似ています。
遷移元素は同周期元素どうしで性質が似ています。
元素の性質は価電子で決まるといっても良いくらいですからね。
遷移元素の特徴
遷移元素はすべて金属ですよ。
単体は比重が大きくて、融点の高いものが多いです。
ちなみに、金属は比重によって軽金属と重金属とに分けられます。
\(\mathrm{Sc:3.0g/cm^3}\)
\(\mathrm{Ti:4.5g/cm^3}\)
以外の遷移元素は \(\mathrm{5g/cm^3}\) 以上の比重を持つので重金属となります。
同じ元素でも複数の酸化数をとることが多いです。
多くの遷移元素は+2と+3の酸化数をとりますが、他の酸化数をとる元素もあります。
例えばマンガンは+2,+4,+7価の酸化数をとります。
酸化物の中で、
酸化数の低い化合物は塩基性酸化物、
\(\mathrm{MnO}\) :酸化数+2
酸化数の高い化合物は酸性酸化物、
\(\mathrm{Mn_2O_7}\) :+7
中間くらいの酸化物は両性酸化物、
\(\mathrm{MnO_2}\) :+4
としての性質を示すことも特徴の1つですね。
安定な錯イオンをつくりやすく、有色のイオンや化合物を持つものが多いです。
\(\mathrm{Fe^{2+}}\) :淡緑色
\(\mathrm{Fe^{3+}}\) :黄褐色
\(\mathrm{Cu^{2+}}\) :青色
などなど、他にもたくさんありますのでできるだけ化合物の色は覚えておいた方が良いです。
単体、化合物ともに触媒としてはたらくものが多いです。
遷移元素は電子殻の軌道が完全に満たされていないものが多く、この軌道と反応する分子が一種の共有結合をつくり、もとの分子の結合が弱まるために新たな共有結合が生まれやすくなるからですが、あまり深く考えなくて良いです。w
触媒としてはたらくものが多い、と覚えておいて下さい。
この後、銅、銀、鉄と個別に見ていきますが先ずは遷移元素の全体的な性質、特徴を覚えておいて下さいね。
大切なポイントは、
典型元素は原子番号の増加とともに規則的に性質が変化し、同族で性質が似ていて、
遷移元素は原子番号が増加しても性質はあまり変化せず、同族元素と似ている他に、同周期でも性質が似ている、
ということです。
周期表
の確認はしておきましょう。
原子番号20までの元素は暗記が必要です。
特に、ハロゲンは別に覚えておくと良いことあります。