錯イオンを詳しく理解するには高校化学を出なくてはならなくなります。化学基礎でも書いた事ですがここでも錯イオンの表し方と読み方、それと立体構造が配位子と配位数によってどのように変わるのか代表例で見ておきましょう。典型元素、遷移元素の安定性についてはあまり触れないことにします。
錯イオン
非共有電子対をもつ分子や陰イオンが金属原子のイオンに配位結合してできた多原子イオンを「錯イオン」といいます。
このとき金属イオンに配位結合した分子やイオンを「配位子」といい、配位結合した配位子の数を「配位数」といいます。
配位子の数を数えるときはギリシャ語の数詞を用いて表します。
※
モノ、ジ、トリ、テトラ、ペンタ、ヘキサ、ヘプタ、オクタ、ノナ、デカ
の10までは化学で良く使いますので覚えておいた方が良いですよ。
※※
配位結合も共有結合の一種です。一旦配位してできた配位結合はもとの共有結合とは区別できないのでしっかり覚えておいて下さいね。センター試験でも問われていましたよ。
錯イオンがイオン結合してできた塩を「錯塩」といいます。
例えば、
\(\mathrm{Na_2[Zn(OH)_4]}\) : テトラヒドロキシド亜鉛(Ⅱ)酸ナトリウム
\(\mathrm{Na[Al(OH)_4]}\) : テトラヒドロキシドアルミン酸ナトリウム
などがそうです。
錯イオンの多くは遷移元素の金属イオンで安定してできるイオンですが、典型元素の金属でも錯イオンは存在します。
金属ごとの錯イオンは後で例をあげますが、先ずは配位子の種類を見ておきましょう。
配位子の種類(読み方)
水 : \(\mathrm{H_2O}\) (アクア)
アンモニア : \(\mathrm{NH_3}\) (アンミン)
シアン化物イオン : \(\mathrm{CN^-}\) (シアニド)
塩化物イオン : \(\mathrm{Cl^-}\) (クロリド)
水酸化物イオン : \(\mathrm{OH^-}\) (ヒドロキシド)
錯イオンの表し方
錯イオンの例を
「テトラアンミン銅(Ⅱ)イオン」: \(\mathrm{[Cu(NH_3)_4]^{2+}}\)
として説明します。
配位子は「( )」でくくり、配位子数を右下に書きます。
配位子 : \(\mathrm{(NH_3)}\) 配位子数:4
次に錯イオン全体を「[ ]」ではさみ、右上に電荷を示します。
電荷 : 2+
※
[ ] と〔 〕は違いますので書き分けて下さいね。
これが錯イオンの表し方です。
読み方の順序は、
配位子の数をギリシャ語の数詞で:テトラ
配位子名:アンミン
金属元素名と酸化数:銅2(どう・に)
に「イオン」をつけて読みます。(日本語読みは人によって変わることがあります。)
「テトラアンミンどう2イオン」
この場合は陽イオンなので「~イオン」ですが、錯イオンが陰イオンの場合は「~酸イオン」と読みます。
錯イオン自体の価数は普通読みません。(陰イオンの価数から判断できる)
強調したいときは「ツープラス」といえば良いです。
錯イオンの立体構造
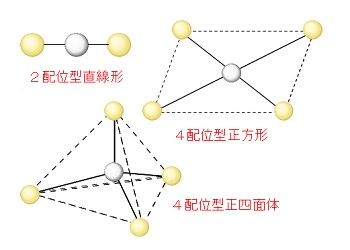
錯イオンの立体構造は金属イオンの配位数によって決まります。
配位子どうしは金属元素を中心にできるだけ距離を保つように配置されることを覚えておけばだいたい想像はつきますが、4配位の場合は平面でつくられる正方形型と正四面体型がありますので覚えておくしかない、といって良いでしょう。
良く出てくる4つの錯イオンの立体構造を示しておきます。
ジアンミン銀(Ⅰ)イオン : \(\mathrm{[Ag(NH_3)_2]^+}\)
銀イオンは配位数が2と決まっているので直線型しかありません。
テトラアンミン銅(Ⅱ)イオン : \(\mathrm{[Cu(NH_3)_4]^{2+}}\)
4配位型の銅の錯イオンは正方形です。
銅を中心に平面で四方に配位します。
テトラアンミン亜鉛(Ⅱ)イオン : \(\mathrm{[Zn(NH_3)_4]^{2+}}\)
4配位型の亜鉛の錯イオンは正四面体です。
正四面体の中心に亜鉛元素があり、正四面体の各頂点に配位子が配置する構造です。
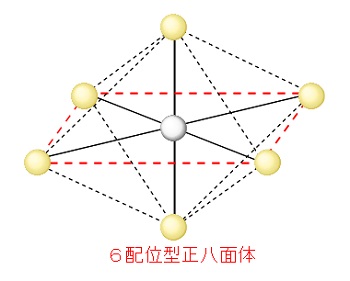
ヘキサシアニド鉄(Ⅱ)酸イオン: \(\mathrm{[Fe(CN)_6]^{4-}}\)
6配位型の立体構造は正八面体となります。金属元素を中心に平面上に正方形配置4つ、上下に2つ配置した形です。
錯イオンは配位結合がカギになります。
配位結合とはどのような結合だったか、
と合わせて見直しておくと良いです。
化学基礎のときにはピンとこなくても、今はしっかり理解しましょうね。w