2019年(平成31年)センター試験化学基礎の解答解説です。
化学基礎は第1問と第2問の2問だけなのですができるだけ詳しく説明を入れますので2つに分けて解説します。
平成最後、センター試験としても最後の年になりましたが、大学入学共通テストに変わっても化学基礎は同じ形で残ります。
2019年度センター試験化学基礎の問題
問題と正答は大学入試センターで発表されていますので確認してください。
解説中のサイト内の解説ページへのリンクは外してあります。
詳しく復習したいときはサイト内でほとんど解説してありますので、
「サイト内検索」にキーワードを入力してみてください。
2019年度センター試験化学基礎第1問の解説
第1問は問1から問7まであります。
問1
原子について、原子番号、陽子数、中性子数、電子数、質量数を把握しているかの確認問題です。
\(\Large{^{\color{red}{19}}_{\hspace{3pt}\color{blue}{9}}\mathrm{A}}\)
この原子\(\,\mathrm{A}\,\)は電気的に中性であるということです。
原子番号\(\,\color{blue}{9}\,\)
陽子数\(\,\color{blue}{9}\,\)
電子数\(\,\color{blue}{9}\,\)
質量数\(\,\color{red}{19}\,\)
なので
中性子数\(\,\color{red}{19}-\color{blue}{9}=\color{magenta}{\underline{ 10 }}\,\)
また、電子は電子殻の内側\(\,\mathrm{K}\,\)殻から\(\,2,8,18\,\)の順に入っていくので、
電子が\(\,\color{blue}{9}\,\)個のこの原子は\(\,\mathrm{K}\,\)殻に\(\,2\,\)個入り、\(\,\mathrm{M}\,\)殻に\(\,7\,\)個で電子はなくなります。
最外殻電子数は\(\,\mathrm{M}\,\)殻の\(\,7\,\)個
この問題は『誤りを含むもの』を選びます。
中性子数は\(\,\color{magenta}{10}\,\)個あるので、
\(\,9\,\)個の中性子
という記述は誤り。答え\(\color{black}{\fbox{ ③ }}\)
問2
物質の分離の操作方法についての名称確認です。
『ア 固体が直接気体になる変化を利用して、』
固体から液体を経由せず。直接気体になることを昇華といいます。
この性質を利用した分離法を昇華法または単に昇華といいます。
答え \(\color{black}{\fbox{ ④ }}\)
『イ 溶媒に対する物質の溶けやすさの違いを利用して、』
溶媒は種類によって性質(極性)が違います。
水のように極性の高い溶媒によけやすい物質、逆に有機溶剤のように極性の低い溶媒などに溶けやすい物質があります。
極性だけでは決まりませんが簡単に言うと水性と油性の違いのようなものです。
水性(極性が高い)物質は水に溶けやすく、油性(極性が低い)物質は有機溶媒に解けやすいです。
油性の混合物でも酸性にすると水に溶け出す物質もあります。
イオンになる(電気を帯びる)物質ですね。
ただ、ここでは溶媒に対する溶けやすさの違いを利用する、ことだけ考えれば良いです。
溶媒に溶かして分離することを抽出といいます。
答え \(\color{black}{\fbox{ ② }}\)
問3
混合物の含有率(含んでいる割合)計算です。
気をつけて欲しいのは問題の最初のページに原子量が書かれています。
このことを忘れていたら、たぶん原子量を覚えてはいないだろうから答えは出せません。
\(\,\mathrm{O=16\,,\,Ni=59}\,\)
ですよ。
\(\,\mathrm{Ni}\,\)を含む合金全体で\(\,\mathrm{6.0\,g}\,\)あって、
その一部が\(\,\mathrm{Ni}\,\)でその\(\,\mathrm{Ni}\,\)を\(\,\mathrm{NiO}\,\)として取り出すと\(\,\mathrm{1.5\,g}\,\)
ここまでをイメージすると
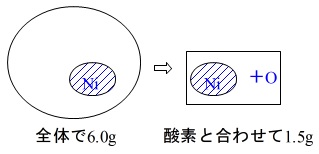 ですがわかりにくいですね。
ですがわかりにくいですね。
\(\,\mathrm{Ni+O=59+16=75}\,\)
なので\(\,\mathrm{NiO}\,\)が\(\,75\,\mathrm{g}\)あればその中に\(\,\mathrm{59\,g}\,\)の\(\,\mathrm{Ni}\,\)が含まれます。
だから\(\,\mathrm{1.5\,g}\,\)の\(\,\mathrm{NiO}\,\)中には
\(\displaystyle \,1.5\times \frac{59}{75}\,\)
の\(\,\mathrm{Ni}\,\)が含まれています。
この計算は比例計算になじみのない人は比例式でも良いですよ。
\(\begin{eqnarray}\displaystyle
75:59&=&1.5:x\\
75x&=&59\times 1.5\\
x&=&\frac{59\times 1.5}{75}
\end{eqnarray}\)
これが\(\,\mathrm{6.0\,g}\,\)の合金中の\(\,\mathrm{Ni}\,\)の分量です。
よって含有率は
\(\hspace{10pt}\displaystyle \frac{\frac{59\times 1.5}{75}}{6}\times 100\\
\displaystyle =\frac{59\times 1.5}{75}\times \frac{1}{6}\times 100\\
\displaystyle =\frac{59}{3}\\
=19.6\cdots\\
≒\underline{20} (%)\)
答え \(\color{black}{\fbox{ ⑤ }}\)
比例計算の説明はこのサイトにもありますが、
中学生向けの数学のサイトに詳しく書いてありますので参考にしてください。
化学の計算問題を比例なしで考えることはありません。
問4
\(\,\mathrm{Cl_2}\,\)と\(\,\mathrm{HCl}\,\)と\(\,\mathrm{H_2O}\,\)が混じっている気体から
\(\,\mathrm{HCl}\,\)と\(\,\mathrm{H_2O}\,\)を取り除きたい
ということです。
濃硫酸は\(\,\mathrm{H_2O}\,\)を取り除きます。
水は\(\,\mathrm{HClを}\,\)取り除きます。
このとき順序はどうすれば良いか、収率の問題です。
硫酸で\(\,\mathrm{H_2O}\,\)を取り除いた後、水で\(\,\mathrm{HCl}\,\)を取り除く
または
水で\(\,\mathrm{HCl}\,\)を取り除いた後、硫酸で\(\,\mathrm{H_2O}\,\)を取り除く
どちらが\(\,\mathrm{Cl_2}\,\)はより純度高く集まるでしょう?
硫酸で\(\,\mathrm{H_2O}\,\)を取り除いた後、水で\(\,\mathrm{HCl}\,\)を取り除く
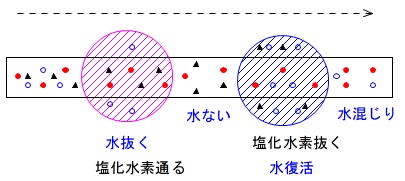
の場合、先に一度硫酸で\(\,\mathrm{H_2O}\,\)を取り除いていますが、次の水溶液で水があります。
水で\(\,\mathrm{HCl}\,\)は取り除かれますが、
水溶液の水蒸気が再び\(\,\mathrm{Cl_2}\,\)に混ざるので最初の濃硫酸による\(\,\mathrm{H_2O}\,\)の除去は意味がありません。
水で\(\,\mathrm{HCl}\,\)を取り除いた後、硫酸で\(\,\mathrm{H_2O}\,\)を取り除く
が正しい順序です。
水溶液には塩化水素\(\,\mathrm{HCl}\,\)が溶けていくので水素イオン濃度は大きくなります。
水素イオン濃度が大きいほど\(\,\mathrm{pH}\,\)は小さくなります。
答え \(\color{black}{\fbox{ ④ }}\)
問5
原子と元素の性質の確認です。
イオン化エネルギーとは、
原子から1個の電子を取り出し1価の陽イオンにするのに必要なエネルギーををいいます。
イオン化エネルギー小さいほど陽イオンになりやすいのでこの記述が誤りです。
他の記述は正しいです。
典型元素で周期表で縦の列で性質が似ていますが、
遷移元素では同じ周期の横に並んだ元素同士で性質が似ています。
答え \(\color{black}{\fbox{ ① }}\)
問6
共有電子対と非共有電子対についてです。
共有電子対は価標(原子同士の結合を示すときの結んだ線)で表されますが、
非共有電子対は価標では表せないので見分ければいいです。
1つの原子の周りには8つの電子があることを考えておきましょう。
(水素原子は\(\,2\,\)個です。)
アンモニア分子\(\,\mathrm{NH_3}\,\)

アンモニウムイオン\(\,\mathrm{NH_4^+}\,\)
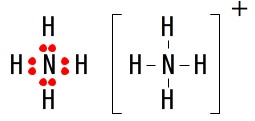
オキソニウムイオン\(\,\mathrm{H_3O^+}\,\)
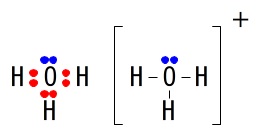
二酸化炭素\(\,\mathrm{CO_2}\,\)
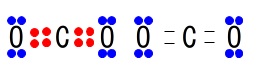
オキソニウムイオンには共有電子対が\(\,3\,\)組と非共有電子対は\(\,1\,\)組です。
答え \(\color{black}{\fbox{ ③ }}\)
問7
身のまわりにある物質の性質です。
塩化カルシウム:\(\,\mathrm{CaCl_2}\,\)
塩酸と水酸化カルシウムの中和でできる塩と考えれば、強酸と強塩基の塩なので水溶液は中性です。
水和物になることが多いので乾燥剤として使われます。
他にも水に溶けやすく凝固点降下をさせやすいので凍結防止のため寒い時期の道路にまかれますが有害です。
炭酸水素ナトリウム:\(\,\mathrm{NaHCO_3}\,\)
水素が残った塩ですが、水酸化ナトリウムと炭酸の塩と考えれば、強塩基と弱酸の塩なので水溶液は塩基性です。
加熱すると二酸化炭素を発生するので調理用の添加物として使用すれば、ふわっとしたパン生地になるのでベーキングパウダーとして利用されることが有名です。
通称は重曹と呼ばれます。
炭酸ナトリウム\(\,\mathrm{Na_2CO_3}\,\)
水溶液では炭酸が弱酸なので水素イオンを引き取り一部炭酸になるので、水酸化物イオンの比率が多くなるため塩基性を示します。
\(\,\mathrm{NaCO_3 \rightarrow 2Na^++\color{red}{CO_3^{2-}}}\,\)
\(\,\mathrm{\color{red}{CO_3^{2-}}+H^+ \rightleftharpoons HCO_3^+}\,\)
\(\,\mathrm{HCO_3^++H^+ \rightleftharpoons H_2CO_3}\,\)
炭酸カルシウム\(\,\mathrm{Ca_2CO_3}\,\)
強塩基の水酸化カルシウムと弱酸の炭酸との中和のときにできる塩なので、水溶液では塩基性です。
石灰水(\(\,\mathrm{Ca(OH)_2}\,\))に二酸化炭素を通すと白く濁ることから二酸化炭素の検出に使われるのが石灰水で、
そのときできる塩が炭酸カルシウムです。
\(\,\mathrm{Ca(OH)_2+CO_2 \rightarrow CaCO_3+H_2O}\,\)
硫酸バリウム\(\,\mathrm{Ba_2SO_4}\,\)
強酸と強塩基の中和でできる塩なので水溶液で中性です。
ただし、ほとんど水に溶けない、溶解度の小さな塩です。
健康診断のときに飲ませる造影剤『バリウム』と呼ばれるものはこの硫酸バリウムのことです。
以上のことから判断すると
\(\,\mathrm{a}\,\) 答え \(\color{black}{\fbox{ ② }}\) 炭酸水素ナトリウム:\(\,\mathrm{NaHCO_3}\,\)
\(\,\mathrm{b}\,\) 答え \(\color{black}{\fbox{ ⑤ }}\) 硫酸バリウム\(\,\mathrm{Ba_2SO_4}\,\)
\(\,\mathrm{a}\,\) 答え \(\color{black}{\fbox{ ① }}\) 塩化カルシウム:\(\,\mathrm{CaCl_2}\,\)
第1問は以上です。
第2問は化学的な法則と気体の体積や中和滴定などです。
少し計算問題がありますが、やはり比例です。
⇒ 共通テスト(センター試験~)の化学と化学基礎の過去問解説
数年分見ておくと傾向ははっきりします。
共通テストになっても内容が変わるわけではありません。