原子は原子核とそれを取り巻くように存在している電子とで構成されています。原子の中で電子がどのように配置されているのか電子殻とその殻におさまる電子数を見ておきましょう。この電子配置によって化学的性質が変わりますので大切なところです。
電子殻
原子の中にある電子は原子核のまわりにいくつかの層にわかれて存在しています。
この層を電子殻(でんしかく)といいます。
電子殻は内側からK殻,L殻,M殻,N殻です。
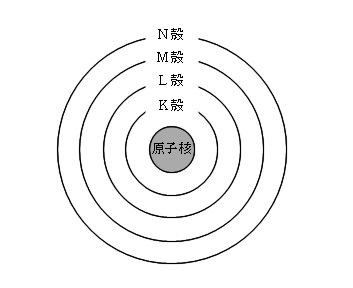
電子殻に入りきる電子数
各電子殻に入ることのできる電子の数は限りがあって、
K殻に2個、L殻に8個、M殻に18個、N殻に32個
となります。
これは原子核に近い順にK殻を第1殻、L殻を第2殻、・・と見れば、
\( n\) 番目の第 \( n\) 殻には \(\color{red}{2n^2}\) この電子が入ります。
電子配置
原子番号が大きくなると原子核の周りの電子数も多くなります。
電子は普通内側にある電子殻(K殻)から順番に入っていきます。
内から入った電子が電子殻に収容できる数を超えるとその外側の殻に入っていきます。
例えば、
酸素 \( _8 \mathrm O\) は電子が8個ありますが、
K殻に2個入り、残りの6個はL殻に入ります。
ナトリウム \(_{11} \mathrm Na\) は電子が11個ありますが、
K殻に2個入り、L殻に8個入ります。
残りの1個はその外の殻のM殻に入ります。
ちょっと違う規則性を示す場合もあります。
カリウム \( _{19} \mathrm K\) は電子が19個ありますが、
K殻に2個入り、L殻に8個入ります。ここまでは同じ規則性です。
ところが残りの9個はその外の殻のM殻(最大18個入ることができる)にすべて入るのではなく、
M殻に8個入り、残りの1個はその外のN殻に1個入ります。
これはM殻に9個入るより、
M殻に8個入り安定なアルゴンの状態をつくり、N殻に1個入った状態の方が安定だからです。
周期表で確認するとわかりますが「希ガス」原子の電子配置が安定します。
※
化学基礎の範囲ではないかもしれませんが、
アルゴンのような安定した電子配置をオクテットといいます。
これもエネルギーの安定性から考えれば規則性があるのですが、数だけ見れば例外になります。
でも、電子が内側のK殻から入りだんだん外に配置されて行くことには変わりありません。
このような電子の配列の仕方を電子配置といいます。
電子配置についてまとめておきます。
電子は原則として内側の電子殻から外側の電子殻に配置されていきます。
電子は殻の最大収容電子数を越えて配置されることはない。
ということです。
原子の持っている電子の数は
で確認しておいてくださいね。
化学的性質を大きく左右する「価電子」を含めた電子配置についてお伝えします。