溶けている溶質が少量の希薄溶液では蒸気圧と凝固点は降下し、沸点は上昇します。この蒸気圧降下、沸点上昇、凝固点降下について説明しておきます。良く出題される項目なので用語と共にしっかり覚えておきましょう。
希薄溶液とは
溶けている溶質どうしの相互作用が及ばないような濃度の小さな溶液を希薄溶液といいます。
希薄溶液では溶媒が溶質に対し十分に存在するため溶質どうしの距離を十分に保つことができます。
気体の場合の理想気体の状態と同じですね。
だから溶質の種類に関係なく溶けている溶質の物質量(mol)だけによって決まる束一性と呼ばれる性質を示します。
※
溶質の溶けている割合が大きくなると溶質どうしが相互作用するので希薄溶液の性質は示さなくなります。
(濃度の大きい溶液を濃厚溶液といいます。)
実在気体をあまりあつかわないのと同じで、濃厚溶液についても束一性がないのであつかいません。
蒸気圧降下
純粋な液体は一定の温度では一定の蒸気圧を示します。
液体の一部が気体になっていると言うことですよ。
ところが、
電解質でも非電解質でも不揮発性の物質を溶かした溶液では、もとの純粋な溶媒の蒸気圧よりも低い蒸気圧を示すようになります。
これを「蒸気圧降下」といいます。
蒸気圧が低いということは気体になりにくいということになりますね。
蒸気圧降下を実感には洗濯物の乾き方を想像すればいいです。
海水で濡れた服と真水で濡れた服では、海水で濡れた服の方が乾きにくい。
汗をかいたままの服と水で洗い流した服では洗い流した服の方が乾きやすい。
(汗をかいたまま乾かすと臭くなるので洗い流した方が良いですよ。笑)
これは蒸気圧降下の例です。
※
溶けている溶質に対する溶媒の比率が下がるため蒸気圧が下がります。
※※
揮発性の物質が溶質の場合は蒸気圧が上昇する場合もあれば下降する場合もあります。
不揮発性の溶質の場合しか問題にはならないと思いますが頭の隅にでもおいてください。
沸点上昇
不揮発性の物質を溶かした溶液の蒸気圧は純粋な溶媒のときよりも低くなります。
そのため、不揮発性物質が溶けた溶液の沸点は純溶媒よりも高くなります。
この現象が沸点上昇です。
例えば水の沸点は100℃ですが、塩を加えると沸点は100℃を超えます。
沸騰しにくくなるということです。
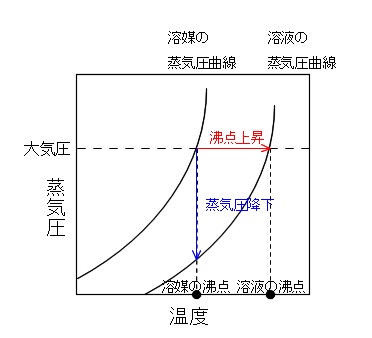
どういうことかと言うと、
沸騰するのは蒸気圧と大気圧が等しくなったときです。
大気圧は一定と考えているので、
蒸気圧が下がるということは沸点となる「蒸気圧」=「大気圧」になる温度が上昇するので沸点も上昇するということです。
溶媒と溶液の沸点の差を「沸点上昇度」といいます。
問題では水1kgに溶質が非電解質であれイオンであれ物質量で1mol溶けた状態の「水のモル沸点上昇」は0.52とすることが多いですが、問題に与えられるか、計算して求めることになるので覚えなくても良い数値です。
(おおよその数値は覚えておくと良いです。)
凝固点降下
沸点の場合とは逆に、溶液は純溶媒よりも凝固点が低くなります。
この現象を凝固点降下といいます。
真水よりも海水の方が凍りにくいということです。
このように溶液では純溶媒よりも、
沸点は上昇し、凝固点は降下します。
純溶媒と溶液との沸点の差を沸点上昇度、凝固点の差を凝固点降下度といいます。
沸点上昇度、凝固点降下度は溶質には関係せず、
溶媒の種類によって決まっています。
例えば水の凝固点は0℃ですが、
水1kgに0.1molの非電解質を溶かした溶液では凝固点は-0.185℃となります。
問題には非電荷質1molを溶かしたときの「水のモル凝固点降下を1.85とする」などと書かれている事が多いです。
このように希薄溶液では沸点上昇度、凝固点降下度共に溶液の質量mol濃度に比例します。
次の関係式があります。
溶質の分子量を \(M\) 、溶質の質量を \(w\) 、溶質の質量を \(W\) とすると沸点上昇度、及び凝固点降下度 \(\mathrm{\Delta t}\) は、
\(\displaystyle \color{red}{\mathrm{\Delta t}=k\times \frac{w\times 1000}{M\times W}}\)
ここで \(k\) は比例定数で、溶媒1kgに1molの溶質を溶かしたときの \(\mathrm{\Delta t}\) の値です。
溶媒が水の場合比例定数が同じだということを覚えておくと計算問題が楽になりますよ。
※
この \(\mathrm{\Delta t}\) は、
沸点上昇のときはモル沸点上昇、
凝固点降下のときはモル凝固点降下といいます。
電解質溶液の沸点上昇度と凝固点降下度
非電解質の場合溶解しても電離しないので1mol溶ければ水溶液中でも1molの粒子と考えて良いですが、
電解質の場合、例えば塩化ナトリウム( \(\mathrm{NaCl}\) )だと電離するので1mol溶けると2molの粒子が存在することになります。
よって、非電解質の場合に比べて2倍の沸点上昇度、凝固点降下度となります。
塩化カルシウム( \(\mathrm{CaCl_2}\) )の場合だと、
\(\mathrm{CaCl_2} \rightarrow \mathrm{Ca^{2+}}+\mathrm{2Cl^-}\)
と1molの粒子が3molの粒子に電離するので3倍になります。
道路などが凍るのを防ぐ場合は塩化ナトリウムよりも塩化カルシウムの方が効果的だということがこのことだけからもわかります。
他にも理由はありますが、電離して粒子が増える場合は凝固点は下がりやすいということは知っておきましょう。
問題を解く場合は非電解質と電解質ではこの点が違いますので注意が必要ですね。
凝固点降下度の測定実験問題は良く出てきますが、
ちょっと長くなるので別にします。
蒸気圧降下、沸点上昇、凝固点降下の用語と意味はここで覚えておいてください。
沸点上昇と凝固点降下の計算問題と解説はこちらで詳しくしてあります。
問題がレベルアップしていくのでついて行けるところまでで良いですよ。