固体の溶解度は温度によって変化します。この温度による溶解度の違いを表す溶解度曲線と温度差を利用して結晶を析出させる再結晶について説明しておきます。再結晶を利用した析出量の計算問題は良く出るので大切ですよ。
固体の溶解度曲線
固体の溶解度は溶媒の温度によって大きく変化するものとあまり変化しないものがありますが、溶解度の温度変化をグラフにしたものを「溶解度曲線」といいます。
一般的には、温度が高くなると固体の溶解度は大きくなるものが多いです。
溶解度曲線は物質によってそれぞれ違ったものとなります。
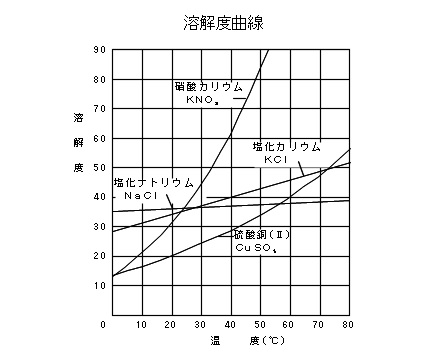
例えば、硝酸カリウム( \(\mathrm{KNO_3}\) )のように溶媒の温度が上昇すると急激に大きくなるものもあれば、塩化ナトリウム( \(\mathrm{NaCl}\) )の溶解度がほとんど変化しないものもあります。
※
例外ですが、水酸化カルシウムなどは溶媒の温度が上昇すると溶解度が少しずつ減少する物質もあります。
※※
溶解度の温度変化は溶質の溶解熱に関係しています。
硝酸カリウムの溶解熱は-34.9kJ、塩化ナトリウムの溶解熱は-3.9kJ、となりますが、
「平衡状態にある物質系に外部から条件を変えるとその影響を打ち消す方向に反応が進み新しい平衡状態になる」
という、「ルシャトリエの原理」に従うからで、
吸熱反応である硝酸カリウムの溶解などでは温度を上げると吸熱の方向に平衡が移動する、つまり溶解が進む、ということになるのです。
このことからも分かるように溶解熱の吸熱量が大きい物質ほど高温にすると溶解度が大きくなります。
逆に、溶解熱が発熱の物質は高温になるほど吸熱方向に平衡が移動するので溶解度は小さくなります。
再結晶とは
硝酸ナトリウムや硝酸カリウムのように、温度によって溶解度が大きく変化する物質では、高温で飽和溶液をつくりその溶液の温度を下げればその溶解度の差の分だけ結晶が析出します。
この場合不純物が少量混じっていたとしても温度を下げても飽和にならず不純物は溶液に残るので、温度による溶解度の差を利用すれば結晶中の不純物を除くことができ純粋な結晶が析出することになります。
このように結晶を一度溶解させ、再び結晶として析出させる操作を「再結晶」といいます。
例えば、塩化ナトリウムを不純物として少量含んでいる硝酸カリウムがあるとします。
これを80℃くらいまで温度を上げた水に飽和溶液となるまで溶かし、
ろ過できる不純物(ゴミなど)を取り除いた後に20℃まで温度を下げると、
溶かした硝酸カリウムのおよそ80%が純粋な \(\mathrm{KNO_3}\) として析出します。
混じっていた少量の塩化ナトリウムは溶解度に達しないため析出しません。
濃縮による再結晶
塩化ナトリウムのように温度の違いによる溶解度に差があまりない物質では、飽和溶液を冷やしてもほとんど結晶が析出しません。
この場合は濃縮して再結晶します。
つまり、蒸発させたりすることで溶媒の比率を減らす、ということです。
ちなみに海水(塩分濃度3~4%)から塩( \(\mathrm{NaCl}\) )を得る場合、海水中にあるイオンはナトリウムイオンと塩化物イオンだけではないので単に濃縮するだけでは純粋な塩化ナトリウムは得られません。
海水中に存在するイオンは、
陽イオンが \(\mathrm{Na^+}\,,\, \mathrm{Mg^+}\,,\, \mathrm{Ca^{2+}}\,,\,\mathrm{K^+}\)
陰イオンが \(\mathrm{Cl^-}\,,\, \mathrm{SO_4^{2-}}\,,\,\mathrm{HCO_3^-}\)
が多くを占めています。
これを濃縮すると溶解度が小さな \(\mathrm{CaCO_3}\) などが \(\mathrm{NaCl}\) よりも先に析出します。
溶媒の溶解度の違いによる再結晶
このほかにも溶媒を変えて再結晶させることもあります。
溶解度は溶媒によって違います。
例えば塩化ナトリウムは水に良く溶けますが、エタノールにはあまり溶けません。
水は極性溶媒でイオンになる物質とは良く水和します。
一方でエタノールは極性があまりないので親水性の強い塩化ナトリウムはあまり溶けません。
だから水に塩化ナトリウムを飽和させ、そこにエタノールを加えると溶媒全体の極性が下がり塩化ナトリウムが再結晶となり析出するということです。
※
エタノールと水は無限に水和(溶けあう)します。
エタノール溶液なのか水溶液なのかは、
⇒ 電解質と非電解質と固体の溶解度の単位と求め方
の記事を読んでおいてください。
溶解度を利用して再結晶をさせる方法は、温度、溶媒の量、溶媒の種類を変えることで可能です。
どの再結晶方法が適しているかは物質の性質を知っておいた方が良いですね。
ちなみにですが、
結晶のできる速さも方法によって違います。
その時できる結晶の形も色も違ってきます。(透明度というべきでしょうか。)
一般的に結晶をつくるときはゆっくり再結晶させるときれいな結晶ができます。
自由研究としてやって見るとおもしろいですが、
食塩水から食塩の結晶をつくるとき、
飽和食塩水を沸騰させ水を蒸発させて白い塩化ナトリウムの結晶を得るか、
自然放置して水が減っていくことによって結晶を得るかで違いを見ると、
結構おもしろい結果が出るかもしれませんよ。笑
再結晶などの基礎化学でも取り上げてある混合物の分離方法は、
⇒ 混合物の分離 分留・再結晶・昇華法・抽出他
を参考に復習しておきましょう。
溶解度の温度差による違いをグラフ化した溶解度曲線は再結晶に利用出来ます。
計算問題も良く出ますのでここに出てくる基本的な問題で良いので練習はしておきましょう。
ある程度の計算もんだなら解けるようになりますよ。