酸性の水溶液と塩基性の水溶液が過不足なく反応するときの中和反応の量的な関係がどうなっているかを見ておきましょう。
中和反応は水溶液に限らず、酸と塩基がそれぞれの性質を打ち消し合う反応です。公式化できるので覚えても良いです。
しかし、水素イオンと水酸化物イオンの数の方が重要ですよ。
中和反応で生成する物質
酸性の水溶液と塩基性の水溶液で中和反応させると、塩と水が生成します。
これはアレニウスの定義による酸から生じる水素イオン(\(\mathrm {H^+}\))と、
塩基から生じる水酸化物イオン(\(\mathrm {OH^-}\))から水ができるからです。
\( \mathrm {H^+}\,+\,\mathrm {OH^-}\,\rightarrow \, \mathrm {H_2O}\)
※
水が生じない中和反応もありますが、
「中和は塩と水が生じる反応」と考えておいて良いです。
中和反応の量的関係
酸と塩基が過不足なく中和反応するには、
酸の出す水素イオン(\(\mathrm {H^+}\))
と、
塩基の出す水酸化物イオン(\(\mathrm {OH^-}\))
の物質量が等しいことが必要になります。
ここは間違えやすいので注意してください。
酸の物質量と塩基の物質量(mol)が等しいのではありません。
水素イオンの物質量と水酸化物イオンの物質量が等しいのですよ。
例えば、
2価の酸である硫酸(\(\mathrm {H_2SO_4}\))と、
1価の塩基である(\(\mathrm {NaOH}\))で、
完全に中和反応をさせようとすると反応式は、
\(\mathrm {H_2SO_4}\,+\,2\mathrm {NaOH} \rightarrow \,\mathrm {Na_2SO_4}+2 \mathrm {H_2O}\)
このように中和の反応式は、
1molの硫酸と2molの水酸化ナトリウムが正塩を生じるまでの反応式を書く必要があります。
さらに、反応式ではわかりませんが、
完全に中和するまでには濃度によって酸と塩基の量は変わってきます。
同じ濃度であれば、
1molの塩酸(\(\mathrm {HCl}\))と反応する水酸化ナトリウム(\(\mathrm {NaOH}\))の量は1molですが、
1molの硫酸(\(\mathrm {H_2SO_4}\))と反応する水酸化ナトリウム(\(\mathrm {NaOH}\))の量は2molです。
いいですか?
完全な中和反応の量は、
「水素イオンと水酸化物イオンの物質量が等しいとき」
ですからね。
このことをしっかり理解していないと後々のpH計算ができなくなってしまいます。
もっといえば、
水素イオン濃度 \(\mathrm{[H^+]}\) や、
水酸化物イオン濃度 \(\mathrm{[OH^-]}\) を求めることすら危うくなります。
中和反応の公式
酸と塩基がちょうど中和したとき、
「酸の出す水素イオンの物質量と塩基の出す水酸化物イオンの物質量が等しい。」
ので、酸の価数と濃度、塩基の価数と濃度の間には次の関係式が成り立ちます。
酸の価数を \( a\)
濃度を \( C\)(mol/L)、
体積を \(V\) (L)
とすると酸の出す水素イオンの物質量は、
\(\displaystyle a \times C \times \frac {V}{1000}\) (mol)
塩基の価数を \(b\)
濃度を \(C’\)(mol/L)、
体積を \(V’\) (L)
とすると酸の出す水素イオンの物質量は、
\(\displaystyle b \times C’ \times \frac {V’}{1000}\) (mol)
なので
\(\displaystyle \large{\color{red}{a \times C \times \frac {V}{1000}= b \times C’ \times \frac {V’}{1000}}}\)
となります。
両方の濃度がモル濃度(mol/L)で表されているときは、
分母の1000という数字は必要無くて、(計算に邪魔なだけです。)
\( \large{\color{red}{a \times C \times V= b \times C’ \times V’}}\)
となります。
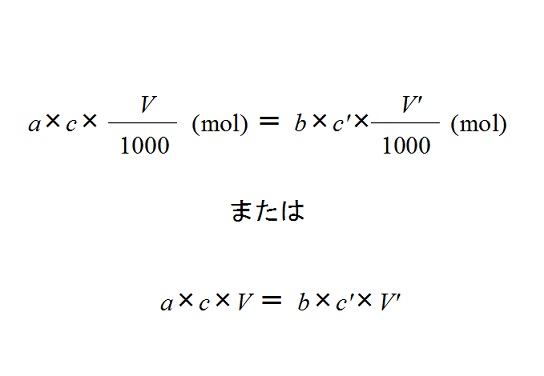
※
酸は英語で「acid」、塩基は英語で「base」なので、
酸と塩基の価数や定数にそれぞれ \(a , b\) を使うことが多いです。
これはあまり気にしなくて良いです。
それよりも、
中和の計算ではモル濃度が重要になりますので
⇒ 質量パーセント濃度の求め方とモル濃度の違い
で十分に復習しておくといいでしょう。
中和の計算問題はちょっとややこしいですけど
で基本はかなり練習できます。
中和していない(仕切れていない)ときの、水素イオン濃度や水酸化物イオン濃度や、
弱酸や弱塩基のpHまで求められるようになることが最終的な目標になります。